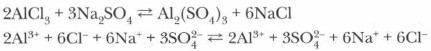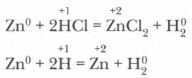|
|
|
|
|
Глава 2. Растворы. Теория электролитической диссоциации § 8. Реакции электролитов в водных растворах и их уравнения
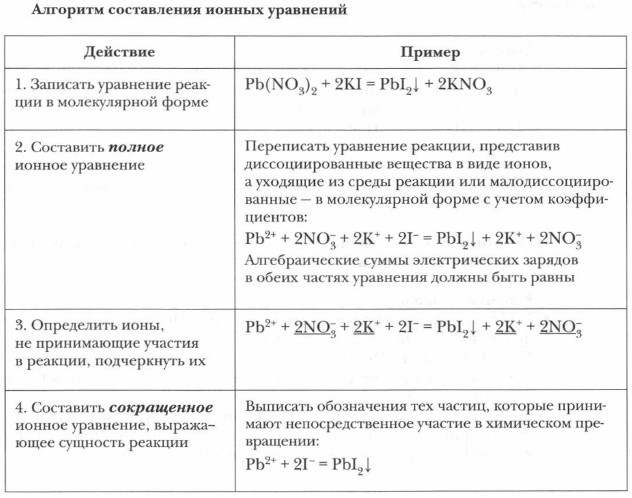
Сформулируйте определение реакций обмена. Приведите примеры. В свете представлений теории электролитической диссоциации реакции в водных растворах протекают между частицами (ионами или молекулами), реально присутствующими в растворе. Реакции между ионами называются ионными, а описывающие их уравнения — ионными уравнениями. При составлении последних необходимо учитывать, что нерастворимые, малорастворимые (выпадающие в осадок) (см. таблицу растворимости), слабодиссоцииро- ванные вещества (например, вода) мало диссоциируют в растворах на ионы и не могут изображаться в виде ионов. Рассмотрим последовательность действий при составлении ионных уравнений на конкретном примере взаимодействия нитрата свинца и иодида калия.
Если выпарить образовавшийся в результате реакции раствор, то получим смесь четырех солей: сульфата натрия, хлорида алюминия, хлорида натрия и сульфата алюминия. Однако с точки зрения теории электролитической диссоциации в данном случае реакция не происходит, так как образующиеся продукты растворимы и в растворе существуют в виде ионов. Реакции электролитов в растворах делятся на две большие группы: окислительно-восстановительные и обменные, или реакции ионного обмена. В первой группе реакций происходит изменение степеней окисления атомов элементов. Например:
В группе реакций ионного обмена степени окисления атомов остаются неизменными.
|
|
|



 Какие типы реакций вам известны?
Какие типы реакций вам известны?
 Рассмотрим еще один пример — взаимодействие растворов хлорида алюминия и сульфата натрия:
Рассмотрим еще один пример — взаимодействие растворов хлорида алюминия и сульфата натрия: