|
|
|
|
|
Глава 2. Постоянный электрический ток § 2.12. Гальванические элементы
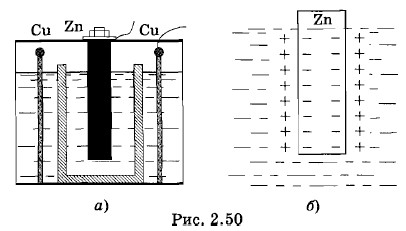
Гальванические элементы в простейшем варианте состоят из двух химически различных электродов, опущенных в водный раствор того или иного электролита. Первый гальванический элемент, состоящий из медного и цинкового электродов, переложенных смоченным соленой водой сукном, был изобретен итальянским физиком Алессандро Вольта (1745—1827). Опыты Гальвани. Открытие ВольтаГальванический элемент получил свое название по имени итальянского врача и анатома Луиджи Гальвани (1737— 1798), опыты которого дали толчок к исследованиям Вольта. Гальвани пытался обнаружить действие атмосферного электричества на мышцы живого организма — лягушки. Для этого он подвесил препарированную лягушку на медном крючке к железному забору, причем крючок проходил через спинной мозг лягушки. Прижимая крючок к перилам, Гальвани обнаружил сильное сокращение мышц. К счастью, он сумел догадаться, что дело здесь не в атмосферном электричестве. Сокращение наблюдалось всегда, когда прикасались к лапке лягушки двумя различными металлами, находящимися между собой в контакте. Зная, что сокращение мышц возникает при электрическом разряде, Гальвани решил, что открыл «животное электричество», вырабатываемое в организме. Металлический проводник, как полагал Гальвани, позволяет электричеству быстро переходить из одних частей мышцы в другие, что и вызывает их сокращение. Правильное объяснение открытому явлению дал соотечественник Гальвани Вольта. Это объяснение и привело Вольта к созданию первого источника постоянного тока. Вольта понял, что лягушачьи лапки — это лишь чувствительный «животный электрометр», более чувствительный, чем любой другой, и только. Явление же связано с наличием двух разнородных металлов, соприкасающихся с электропроводящей жидкостью животных тканей. Отсюда Вольта извлек идею первого гальванического элемента: набор медных и цинковых кружочков, переложенных смоченным соленой водой сукном. Это был «вольтов столб» — «самый замечательный, — по словам Араго, — прибор, когда-либо изобретенный людьми». Вскоре были изобретены другие гальванические элементы: элемент Даниэля, Грене, Лекланше, нормальный элемент Вестона и др. Рассмотрим более подробно основные принципы работы гальванических элементов на примере элемента Даниэля, хотя практически этот элемент в настоящее время не используют. Протекающие в нем процессы наиболее просты. Элемент ДаниэляЭлемент Даниэля устроен так: в стеклянный сосуд помещен стакан из пористой необожженной глины (рис. 2.50, а); во внутренний стакан налит водный раствор соли ZnSO4 (цинковый купорос), а во внешний — раствор медного купороса (CuSO4); в качестве электродов используют цинк и медь. Пористая перегородка препятствует быстрому перемешиванию растворов электролитов, но позволяет просачиваться ионам разных знаков.
Посмотрим вначале, что происходит с цинковым электродом. Если бы во внутреннем сосуде была серная кислота H2SO4, то началась бы химическая реакция, в результате которой цинковый электрод растворялся бы с образованием соли ZnSO4. Тот же процесс происходит и в растворе соли цинкового купороса, если концентрация ионов цинка в нем не слишком велика. Причем в раствор переходят не нейтральные атомы цинка, а его положительные ионы, несущие двойной элементарный заряд (Zn2+). Этот процесс — результат действия химических сил, имеющих электромагнитную природу, но очень сложных по своему характеру. Мы не будем вникать в причины появления химических сил и в особенности их действия. Важно следующее: цинковый электрод заряжается отрицательно, так как каждый уходящий атом цинка оставляет два своих электрона, а раствор электролита заряжается положительно. Одновременно происходит и обратный процесс. Участвующий в тепловом движении молекул ион цинка может снова осесть на электроде. После опускания цинкового стержня в электролит с течением времени установится равновесное состояние, при котором число ионов цинка, покинувших электрод в единицу времени, равно числу ионов, осевших на нем за это же время. Выясним условия возникновения этого равновесия. По мере растворения цинка между электродом и раствором электролита появляется возрастающая разность потенциалов, так как цинк заряжается отрицательно, а раствор — положительно (рис. 2.50, б). Следовательно, в очень тонком слое контакта электрод — раствор возникает электрическое поле. Это поле препятствует выходу ионов Zn2+ из электрода. Растворение прекратится, когда сила электрического поля станет равной по модулю химической силе, вызывающей переход ионов Zn2+ в раствор. Эта химическая сила в рассматриваемом случае есть сторонняя сила, приводящая в движение заряженные частицы (ионы Zn2+) и вызывающая появление электрического тока в цепи. Возникающий на границе электрод — раствор скачок потенциала зависит от концентрации ионов цинка в растворе электролита. Опыт показывает, что при нормальной массовой концентрации* ионов цинка в растворе цинкового купороса (32,7 кг/м3) разность потенциалов между электродом и раствором электролита U1 = -0,5 В. Массовой концентрацией компонента в растворе называется отношение массы компонента к объему раствора. Концентрация считается нормальной, когда масса ионов металла, содержащихся в 1 м3 раствора, численно равна отношению молярной массы металла, выраженной в килограммах на моль, к его валентности. Теперь посмотрим, что происходит с медным электродом в растворе медного купороса. Если массовая концентрация ионов меди в этом растворе является нормальной (31,8 кг/м3), то здесь происходит обратный процесс: ионы меди Си2+ осаждаются на электроде, заряжая его положительно. Раствор медного купороса при этом заряжается отрицательно, так как при переходе иона меди Си2+ из раствора на медный электрод от молекулы CuSO4 в растворе остается ион
В результате изменение потенциала в разомкнутом элементе имеет вид, изображенный на рисунке 2.51. Здесь учтено, что в отсутствие тока потенциалы обоих растворов электролитов одинаковы, так как растворы и пористая перегородка являются проводниками. Разность потенциалов между электродами элемента Даниэля при разомкнутой цепи (она равна по модулю ЭДС элемента) составляет если массовые концентрации ионов в обоих растворах электролитов нормальные.
|
|
|



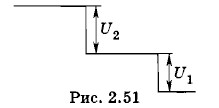
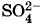 (кислотный остаток). Это продолжается до тех пор, пока скачок потенциала на границе электрод — раствор электролита не достигнет значения U2 = 0,61 В.
(кислотный остаток). Это продолжается до тех пор, пока скачок потенциала на границе электрод — раствор электролита не достигнет значения U2 = 0,61 В.
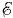 = U2 - U1 = 1,11 В,
= U2 - U1 = 1,11 В,