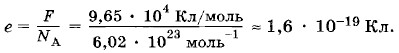|
|
|
|
|
Глава 3. Электрический ток в различных средах § 3.5. Закон электролиза
Масса m выделившегося вещества равна произведению массы одного иона mi;, на число ионов Ni, осевших на электроде за время Δt: m = miNi. (3.5.1) Масса иона, как мы уже знаем, равна
где М — молярная (или атомная) масса вещества, a NA — постоянная Авогадро, т. е. число ионов в одном моле. Число ионов, осевших на электроде,
где Δq = IΔt — заряд, протекший через раствор электролита за время Δt, qi — заряд иона, который равен произведению элементарного заряда е на валентность n атома (или группы атомов), из которого образовался ион: qi = en. При диссоциации молекул, состоящих из одновалентных атомов (n = 1), возникают однозарядные ионы. Например, при диссоциации молекулы бромида калия КВr возникают ионы К+ и Вг-, а при диссоциации молекулы медного купороса CuSO4 получаются два двухзарядных иона Си2+ и Подставляя в формулу (3.5.1) выражения (3.5.2) и (3.5.3) и учитывая, что Δq = IΔt, qi = en, получим:
Закон ФарадеяОбозначим через k коэффициент пропорциональности между массой вещества m и зарядом Δq = IΔt в формуле (3.5.4):
Тогда формула (3.5.4) примет вид:
Следовательно, масса вещества, выделившегося на каждом из электродов, прямо пропорциональна силе тока и времени прохождения тока через раствор электролита. Это утверждение, полученное нами теоретически, впервые было установлено в 1836 г. экспериментально М. Фарадеем и носит название закона электролиза Фарадея. Коэффициент k в формуле (3.5.6) называют электрохимическим эквивалентом вещества и выражают в килограммах на кулон (кг/Кл). Из формулы (3.5.6) видно, что электрохимический эквивалент k численно равен массе вещества, выделившегося на электроде, при переносе ионами через раствор электролита заряда, равного 1 Кл. Электрохимический эквивалент имеет простой физический смысл. Так как
т. е. электрохимический эквивалент данного вещества равен отношению массы иона этого вещества к его заряду. Из формулы (3.5.5) следует также, что электрохимические эквиваленты веществ прямо пропорциональны молярным массам и обратно пропорциональны валентностям этих веществ. При этом надо иметь в виду, что некоторые химические элементы в разных соединениях могут обладать различной валентностью. Так, например, медь одновалентна в соединениях CuCl, Cu2O и еще в некоторых других соединениях и двухвалентна в CuO, CuSO4 и еще в некоторых соединениях. В первом случае, когда медь одновалентна, ее электрохимический эквивалент равен 6,6 • 1-7 кг/Кл, а для двухвалентной меди электрохимический эквивалент в два раза меньше — он равен 3,3 • 10-7 кг/Кл. Постоянная ФарадеяПроизведение элементарного заряда (заряда электрона) е на постоянную Авогадро NA носит название постоянной Фарадея: F = eNA. Введя постоянную Фарадея в формулу (3.5.4), для массы вещества, выделившегося при электролизе на электроде, получим:
Согласно этой формуле постоянная Фарадея F численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде один моль одновалентного вещества. Постоянная Фарадея, найденная из опыта, равна F = 9,65 • 104 Кл/моль. Для выделения на электроде одного моля n-валентного вещества через раствор электролита необходимо пропустить заряд, численно равный произведению nF. Определение заряда электронаЗная постоянную Авогадро NA и постоянную Фарадея F, можно найти модуль заряда одновалентного иона, т. е. заряд электрона:
Любой двухвалентный ион переносит заряд в два раза больший, трехвалентный — в три раза больший и т. д. Но никогда не бывает, чтобы один ион переносил заряд, содержащий дробную часть заряда одновалентного иона. Этот вывод, полученный из закона Фарадея, впервые в истории физики привел к мысли о том, что заряд одновалентного иона (е = 1,6 • 10-19 Кл) представляет собой наименьший (элементарный) заряд, существующий в природе. Любой электрический заряд состоит из целого числа элементарных зарядов. Вывод о существовании в природе элементарного электрического заряда был сделан Гельмгольцем в конце прошлого века (1881), когда в науке еще не существовало представления об электроне. Значение элементарного заряда, вычисленное на основании закона электролиза, совпадает со значением заряда электрона, которое в дальнейшем было получено при исследовании других явлений.
|
|
|





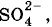 так как атом меди и кислотный остаток в данном соединении двухвалентны (n = 2).
так как атом меди и кислотный остаток в данном соединении двухвалентны (n = 2).



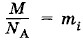 и еn = qi, то, согласно выражению (3.5.5),
и еn = qi, то, согласно выражению (3.5.5),