|
|
|
|
|
Глава 3. Электрический ток в различных средах Упражнение 71. Сплошной металлический цилиндр радиусом R вращается с постоянной угловой скоростью ω. Найдите зависимость напряженности возникающего поля от расстояния r до оси цилиндра и разность потенциалов между поверхностью цилиндра и осью.
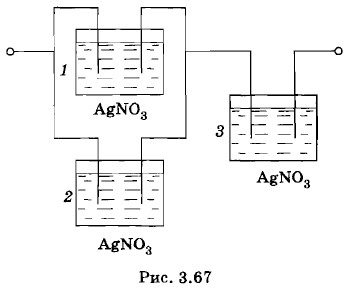
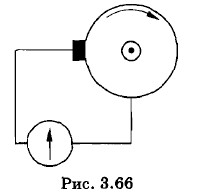
2. С какой частотой п следует вращать металлический диск радиусом R = 25 м (рис. 3.66), чтобы можно было обнаружить разность потенциалов между осью и краем диска, возникшую при его вращении? Чувствительность гальванометра U = 10-5 В/дел. Отношение заряда электрона к его массе 3. Один полюс источника тока к электрической лампочке присоединили медным проводом, а другой полюс — алюминиевым проводом; диаметры проводов одинаковые. Сравните скорости упорядоченного движения электронов в подводящих проводах, считая, что на каждый атом приходится один электрон проводимости. Плотности алюминия и меди соответственно равны 2,7 • 103 кг/м3 и 8,9 • 103 кг/м3, их относительные атомные массы 27 и 64. 4. При электролизе раствора серной кислоты за время t = 50 мин выделился водород массой m = 3 • 10-4 кг. Определите количество теплоты, выделившееся при этом в растворе электролита, если его сопротивление R = 0,4 Ом, а электрохимический эквивалент водорода k = 10-8 кг/Кл. 5. Три электролитические ванны соединены так, как показано на рисунке 3.67. В двух из них имеется раствор AgNO3, а в третьей — раствор CuSO4. Сколько серебра выделилось в первой ванне, если во второй выделилось m2 = 60,4 мг серебра, а в третьей — m3 = 41,5 мг меди? Электрохимический эквивалент серебра kc = 1,118 мг/Кл, меди — kM = 0,329 мг/Кл.
6. Чему равна масса серебра, выделившегося за 1 ч при электролизе раствора AgNO3? Сопротивление раствора электролита 1,2 Ом, напряжение на зажимах ванны 1,5 В, а электродвижущая сила поляризации 0,8 В. 7. При электролизе положительные и отрицательные ионы непрерывно нейтрализуются на соответствующих электродах. Почему концентрация ионов в растворах электролитов поддерживается на постоянном уровне? В каких участках раствора происходит пополнение убыли ионов? 8. Полная плотность тока в растворах электролитов определяется как сумма плотностей двух токов — плотности тока положительных ионов и плотности тока отрицательных ионов: j = e(n+υ+ + n-υ-), где е — модуль заряда иона, n и υ с соответствующими индексами — концентрации и скорости положительных и отрицательных ионов. Почему же масса вещества, выделившегося, к примеру, на катоде, считается пропорциональной полной плотности тока, а не плотности тока en+υ+? 9. При никелировании детали в течение 2 ч на ней отложился слой никеля толщиной d = 0,03 мм. Электрохимический эквивалент никеля k = 3 • 10-7 кг/Кл. Плотность никеля ρ = 8,9 • 103 кг/м3. Определите плотность тока при электролизе. 10. При электролизе за 20 мин при силе тока 2,5 А на катоде выделилось 1017 мг двухвалентного металла. Какова его относительная атомная масса? 11. Сколько пар ионов возникает ежесекундно под действием ионизатора в 1 см3 газоразрядной трубки, в которой течет ток насыщения 4 • 10-8 мА? Площадь каждого плоского электрода равна 1 дм2, а расстояние между ними 5 мм. Считать, что заряд каждого иона равен заряду электрона. 12. При какой напряженности поля начнется самостоятельный разряд в воздухе, если энергия ионизации молекул равна 2,4 • 10-18 Дж, а средняя длина свободного пробега 4 мкм? Какова скорость электронов при столкновении с молекулой? 13. К электростатической машине подключены соединенные параллельно лейденская банка и разрядник. Сила тока электростатической машины I = 10-5 А. Емкость лейденской банки С = 10-8 Ф. Чтобы произошел искровой разряд, машина должна работать t = 30 с. Длительность разряда τ = 10-6 с. Определите среднюю силу разрядного тока Ip и напряжение зажигания искрового разряда Uз*. * Напряжением зажигания Uз называется напряжение, при котором начинается самостоятельный разряд в газах.
|
|
|



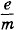 = 1,76 • 1011 Кл/кг.
= 1,76 • 1011 Кл/кг.