|
|
|
|
|
Глава 13. Основы термодинамики § 79. Применение первого закона термодинамики к различным процессамПеречислите известные вам изопроцессы, происходящие с газом. Как записать первый закон термодинамики для различных процессов? С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин, характеризующих состояние газа, остаётся неизменной (изопроцессы). При этом газ будем считать идеальным. Изохорный процессПри изохорном процессе объём газа не меняется, и поэтому работа газа равна нулю. Изменение внутренней энергии газа согласно уравнению (13.12) равно количеству переданной ему теплоты: ΔU = Q. (13.13) Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q < 0 и ΔU = U2 - U1 < 0, изменение внутренней энергии отрицательно и внутренняя энергия газа уменьшается. Для одноатомного газа можно записать: Удельная теплоёмкость газа при изохорном процессе Изотермический процессПри изотермическом процессе (Т = const) внутренняя энергия идеального газа (см. формулу (13.1)) не меняется. Согласно формуле (13.12) всё переданное газу количество теплоты идёт на совершение работы: Q = А'. (13.14) Если газ получает тепло (Q > 0), то он совершает положительную работу (А' > 0). Если, напротив, газ отдаёт тепло окружающей среде (термостату), то Q < 0 и А' < 0. Работа же внешних сил над газом в последнем случае положительна. Удельная теплоёмкость при изотермическом процессе стремится к бесконечности: сT → ∞.
Изобарный процессПри изобарном процессе согласно формуле (13.12) передаваемое газу количество теплоты идёт на изменение его внутренней энергии и на совершение им работы при постоянном давлении: Q = ΔU + А' = ΔU + pΔV.
|
|
|



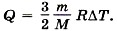
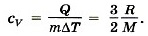
 Выведите выражение для количества теплоты через изменение температуры газа и удельную теплоёмкость газа (р = const).
Выведите выражение для количества теплоты через изменение температуры газа и удельную теплоёмкость газа (р = const).