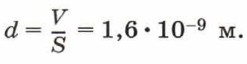|
|
|
|
|
Глава 4. Основы молекулярно-кинетической теории строения вещества § 20. Атомы и молекулы, их характеристикиОсновные положения молекулярно-кинетической теории1. В основе молекулярно-кинетической теории строения вещества лежит несколько положений, с которыми вы уже знакомы из курса физики и химии основной школы. 1. Все вещества состоят из частиц (молекул, атомов, ионов), между которыми есть промежутки. Молекула — мельчайшая частица вещества, сохраняющая его химические свойства. Как вы знаете, существуют простые и сложные вещества. 2. Частицы вещества находятся в непрерывном хаотическом движении. 3. Частицы вещества взаимодействуют между собой: между ними действуют силы притяжения и отталкивания. Эти положения являются обобщением большого числа экспериментальных фактов. Рассмотрим их детальнее. Экспериментальные обоснования существования молекул и атомов2. Идея атомистического строения вещества была высказана в V в. до н. э. древнегреческими философами Левкиппом (V в. до н. э.) и Демокритом (460—370 до н. э.). Значительный вклад в развитие учения о строении вещества внёс российский учёный М. В. Ломоносов. Он считал, что все тела состоят из «элементов» (атомов) — наименьших неделимых частиц. В свою очередь, «элементы» входят в состав более крупных частиц — «корпускул» (молекул).
Михаил Васильевич Ломоносов (1711 —1765) — выдающийся российский учёный, член Петербургской академии наук. Известен своими работами в области физики, химии, астрономии, горного дела, металлургии и др. Экспериментально доказал закон сохранения массы вещества; сформулировал закон сохранения материи и движения; внёс существенный вклад в становление молекулярнокинетической теории строения вещества; разработал теорию атмосферного электричества и теорию цветов; сконструировал целый ряд физических приборов. Косвенное доказательство того, что все вещества состоят из молекул, было получено английским химиком Джоном Дальтоном (1766—1844). В 1803 г. он установил закон кратных отношений, суть которого сводится к следующему. Если какой-либо элемент А вступает в реакцию с элементом В и образует несколько различных соединений С, D и т. д., то при постоянной массе элемента А массы элемента В в соединениях С, D и т. д. будут относиться друг к другу как целые числа. Например, азот и кислород могут образовывать следующие соединения: N2O, NO, N2O3, NO2, N3O5. В них на равные массы азота приходятся массы кислорода, которые относятся друг к другу как 1 : 2 : 3 : 4 : 5. Объяснить это можно тем, что при образовании соединений 2 атома азота присоединяют к себе 1, 2, 3, 4 или 5 атомов кислорода. Другим косвенным подтверждением первого положения молекулярно-кинетической теории строения вещества является диффузия, а также результат опыта по смешиванию воды и спирта (рис. 57). Длинную узкую стеклянную трубку до середины заполним водой и сверху нальём спирт (рис. 57, а). Если перемешать жидкости, то объём смеси окажется меньше суммы первоначальных объёмов воды и спирта (рис. 57, б). Это можно объяснить лишь тем, что молекулы спирта проникают в промежутки между молекулами воды, а молекулы воды — в промежутки между молекулами спирта.
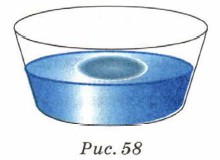
В настоящее время крупные молекулы органических соединений можно наблюдать непосредственно с помощью электронного или ионного микроскопа. Сейчас уже ни у кого не вызывает сомнений то, что все вещества состоят из молекул и атомов. Размеры молекул3. Оценить размеры молекул можно с помощью следующего опыта. Если в широкий стеклянный сосуд налить воду и капнуть на её поверхность каплю оливкового масла, то капля растечётся по поверхности воды и образует плёнку, толщина которой будет равна диаметру одной молекулы (мономолекулярный слой) (рис. 58).
В этом опыте объём капли масла был равен V = 0,9 • 10-9 м3, площадь плёнки S = 0,55 м2. Толщина плёнки, т. е. диаметр молекулы
|
|
|