|
|
|
|
|
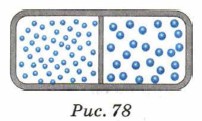
Глава 5. Основные понятия и законы термодинамики § 28. Второй закон термодинамики (окончание)Предположим, что в сосуде, разделённом на две половины перегородкой, находятся два разных газа: например, в левой половине водород, а в правой — кислород (рис. 78).
Если убрать перегородку, то газы с течением времени перемешаются. Наступит равновесие: газы будут иметь одинаковую концентрацию во всех областях сосуда. Состояние газов в начальный момент времени было упорядоченным, так как в левой половине сосуда находились молекулы одного газа, а в правой — другого. Затем вследствие хаотического движения молекулы газов перемешались: произошёл переход от упорядоченного состояния к беспорядочному. Беспорядочное состояние характеризуется выравниванием концентрации газа и других параметров состояния, ему свойственно отсутствие выделенных областей и направлений. Это состояние — равновесное. И в этом случае система переходит от упорядоченного состояния к беспорядочному. Самопроизвольный обратный переход невозможен. Таким образом, система всегда стремится перейти из упорядоченного состояния в неупорядоченное, а самопроизвольный обратный переход невозможен. Вопросы для самопроверки 1. Какой процесс называют необратимым? Приведите примеры необратимых процессов. 2. Являются ли колебания маятника обратимым процессом? 3. Поясните с помощью примера выражение: «Система с течением времени переходит из упорядоченного состояния в неупорядоченное». 4. Может ли система перейти самопроизвольно из неупорядоченного состояния в упорядоченное? В каком случае возможен переход из неупорядоченного состояния в упорядоченное? 5. Сформулируйте второй закон термодинамики. Самоконтроль Выполните в рабочей тетради тренировочный тест 3.
|
|
|