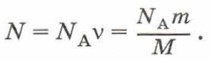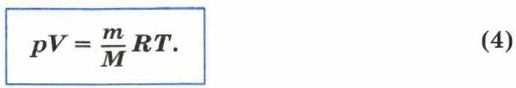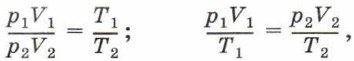|
|
|
|
|
Глава 6. Свойства газов Уравнение состояния идеального газаУравнение Менделеева—Клапейрона3. Число молекул равно произведению постоянной Авогадро NA на количество вещества ν, которое, в свою очередь, равно отношению массы газа m к его молярной массе М, т. е.:
Подставив это выражение в формулу (2), получим:
Произведение постоянной Больцмана k на постоянную Авогадро NA называют универсальной газовой постоянной и обозначают буквой R. R = kNA = 8,31 Дж(моль • К). Универсальная газовая постоянная показывает, какую энергию необходимо сообщить 1 моль идеального газа, чтобы увеличить его температуру на 1 К. Заменив произведение kNA на R в уравнении (3), запишем:
Уравнение (4) так же, как и уравнение (2), является уравнением состояния идеального газа; оно связывает параметры какого- либо состояния газа произвольной массы. Это уравнение называют уравнением Менделеева—Клапейрона. Уравнение Клапейрона4. Предположим, что газ переходит из некоторого состояния 1, которое характеризуется параметрами р1, V1, T2, в состояние 2, которое характеризуется параметрами р2, V2, Т2. При этом масса газа и его химический состав остаются неизменными. Запишем уравнение Менделеева—Клапейрона для первого и для второго состояний газа:
Разделим первое уравнение на второе. Получим:
или
Уравнение (5) называют уравнением Клапейрона. Это уравнение связывает параметры двух состояний газа при неизменной массе газа и его химическом составе.
|
|
|