|
|
|
|
|
Глава 3. Особенности строения и свойств органических соединений и их классификация § 3. Развитие теоретических представлений об электронном и пространственном строении органических соединенийПри изучении органической химии важно опираться не только на общие фундаментальные теории, законы и понятия химии. Необходимо учитывать особенности строения и проявления свойств, индивидуальность каждого изучаемого соединения. Единство всеобщего — особенного — индивидуального, взаимосвязь строения и свойств, генетические связи органических соединений разных классов и видов — таковы принципы, которых мы будем придерживаться при изучении органической химии. Для этого надо хорошо знать не только химическое, но также электронное и пространственное строение изучаемых веществ. На этой основе вы сможете предсказывать, моделировать и объяснять свойства и химические реакции органических соединений.
А.М. Бутлеров не считал теорию химического строения органических соединений абсолютной и неизменной. Он предсказывал её дальнейшее развитие, которое в науке шло в двух направлениях. Сначала развивалось учение о пространственном строении молекул, позднее шло представление об электронном строении веществ, но его мы изложим первым, как более известное вам из курса. Рассмотрим развитие представлений об электронном строении органических веществ. Создание электронной теории строения веществ стало возможным благодаря успехам физики конца XIX-XX вв. в изучении явления радиоактивности, строения атомов, природы химической связи, а также в результате совершенствования методов и аппаратуры исследования электронного строения атомов и веществ. Достижения науки в этой области глубоко проникли в органическую химию, наполнив теорию химического строения органических соединений конкретным физическим смыслом. Изучая химию в основной школе, вы уже применяли знания электронной теории для объяснения строения и свойств органических веществ, использовали электронные схемы строения атомов и химических соединений. Вспомните, что углерод является центральным химическим элементом всех органических соединений, в которых его атомы находятся в возбуждённом состоянии и проявляют валентность, равную IV. Задание. Рассмотрите схемы основного и возбуждённого состояния атома углерода (рис. 2), дайте объяснения этому явлению, используя знания электронной теории.
Большинство химических связей в молекулах органических соединений являются ковалентными. Вы уже знаете их основные характеристики: энергия, длина, насыщаемость и пространственная направленность.
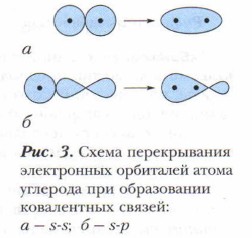
Энергия связи. Процесс образования ковалентной химической связи экзотермический, сопровождается выделением значительного количества энергии, следовательно, образованные ковалентной связью молекулы органических веществ устойчивы, прочны. Энергия измеряется в килоджоулях на 1 моль (кДж/моль). Переход атома в возбуждённое состояние сопряжён с поглощением энергии, что затем с избытком компенсируется процессом образования химических связей атомом углерода (рис. 3). Например, при образовании одного моля метана избыток энергии равен 1662 кДж. Чем больше энергии выделяется при образовании связи, тем прочнее эта химическая связь. Молекулярные соединения при изменении условий легко переходят из одного состояния в другое. В твёрдом виде они (например, глюкоза) имеют молекулярную кристаллическую решётку, в узлах которой размещены молеку лы с невысокой энергией связи друг с другом. Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10-9 м). Она зависит от природы атомов и характера связи между ними (одинарная, двойная, тройная). С повышением кратности связи длина уменьшается. Под насыщаемостью связи понимают способность атомов углерода образовывать строго определённое число ковалентных связей. Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании этой связи. Другим направлением развития теории строения органических соединений было учение о пространственном строении их молекул, ещё в 70-80-е гг. XIX в. названное стереохимией (от греч. stereos — «пространственный»). В развитии пространственных представлений большую роль сыграли понятия: о формах s-, р-, d-электронных орбиталей и их положениях в пространстве, о гибридизации атомных орбиталей, о геометрии молекул, об образовании кратных связей и расположении их в пространстве. О формах и состоянии разных электронных орбиталей в пространстве вам уже немного известно.
Вы также знакомились с геометрией молекул простейших органических соединений (см. учебники для 9 класса). Эту геометрию молекул отражают их объёмные модели, помогающие понять пространственное строение органических веществ. Рассмотрим пространственное строение метана (рис. 4).
Гибридизация атомных орбиталейОпираясь на знания о строении молекулы метана, можно предположить, что четыре ковалентные связи атома углерода, которые он образует с водородом в молекуле метана, будут неравноценными: одна связь образована его s-электроном и три связи — p-электронами. Однако экспериментально доказано, что в действительности все связи С—Н в метане равноценны и направлены к вершинам правильного тетраэдра под углом 109° 28'. Возникает противоречие между теоретическими и экспериментальными данными, которое было успешно устранено идеей о гибридизации атомных орбиталей. Её предложил дважды лауреат Нобелевской премии Л. Полинг в 1931 г. для объяснения пространственного (геометрического) строения молекул и ионов с учётом направленности ковалентной связи (т. е. их формы). Он доказал, что в молекулах веществ нет изолированных друг от друга связей. При образовании связей электронные облака перекрываются, смешиваются, и образуются гибридные электронные орбитали. Таким образом Полинг предложил модельное объяснение выравнивания электронных орбиталей. Особенностью гибридных орбиталей является то, что их электронная плотность по одну сторону ядра значительно больше, чем по другую. Следовательно, грушевидная форма гибридных орбиталей атома углерода обеспечивает большую степень перекрывания электронных облаков при образовании ковалентных связей с другими атомами.
|
|
|



 Запишите электронную формулу метана. Какую информацию о веществе даёт эта формула?
Запишите электронную формулу метана. Какую информацию о веществе даёт эта формула?

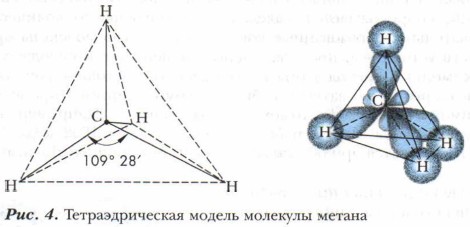
 В возбуждённом атоме углерода при образовании ковалентных связей одна s- и три p-орбитали гибридизируются (смешиваются). Они образуют четыре равноценных, смешанных, или гибридных, облака с одинаковой формой и энергией. Симметрично расположенные в пространстве гибридные sp3-орбитали направлены под одинаковым углом, равным 109° 28', вытянуты по направлению к вершинам тетраэдра. Атом углерода как бы находится в центре тетраэдра, или правильной четырёхгранной пирамиды, а четыре соединённых с ним атома водорода — в её вершинах (см. рис. 4).
В возбуждённом атоме углерода при образовании ковалентных связей одна s- и три p-орбитали гибридизируются (смешиваются). Они образуют четыре равноценных, смешанных, или гибридных, облака с одинаковой формой и энергией. Симметрично расположенные в пространстве гибридные sp3-орбитали направлены под одинаковым углом, равным 109° 28', вытянуты по направлению к вершинам тетраэдра. Атом углерода как бы находится в центре тетраэдра, или правильной четырёхгранной пирамиды, а четыре соединённых с ним атома водорода — в её вершинах (см. рис. 4).