|
|
|
|
|
Глава 4. Теоретические основы, механизмы и закономерности протекания реакций органических соединений Теоретические основы протекания органических реакцийПроблема. Что происходит с органическими соединениями в химических реакциях? Стремление к образованию новых химических связей, обладающих большей энергией, и, следовательно, более стабильных химических систем является сущностью химических реакций. Для установления зависимости строения и свойств веществ, для характеристики их химических реакций важно использовать понятие «реакционная способность». В органической химии принято рассматривать реакционную способность не только соединения в целом, но и отдельных его частиц (атомов, функциональных групп, радикалов, а также отдельных химических связей).
Реакционная способность веществ, участвующих в химической реакции, измеряется скоростью данной химической реакции. Как вы знаете из курса основной школы, скорость химической реакции (υ) определяется изменением концентрации одного из вступивших в реакцию или образующихся в результате реакции веществ в единицу времени и выражается в молях на литр в секунду (моль/л • с). На скорость химической реакции влияют многие факторы: катализатор, поверхность соприкосновения веществ, температура, давление, природа реагентов, их энергетическое состояние, механизм протекания реакции. Даже в какой-либо конкретной реакции реакционная способность одного из реагентов может широко варьироваться под влиянием другого.
Реакционная способность зависит также от природы вещества — состава, строения, внутренней энергии и от природы другого реагента. Поэтому реакционная способность конкретного соединения всегда должна рассматриваться только по отношению к реакционному партнеру.
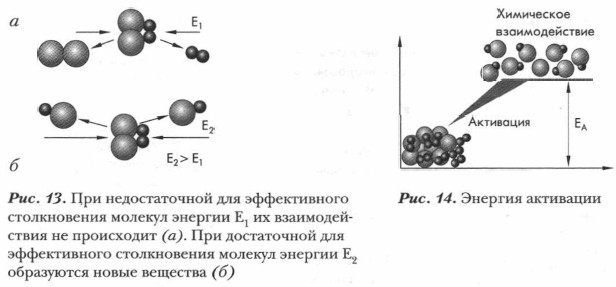
Химическая реакция и образование частиц — продуктов реакции происходит в том случае, если частицы реагентов обладают достаточной энергией (рис. 13).
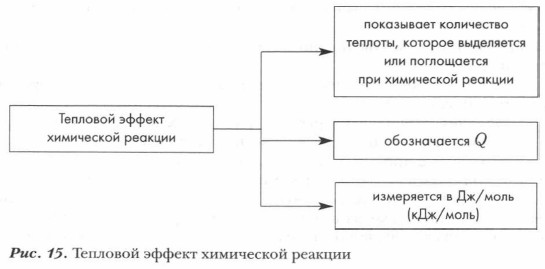
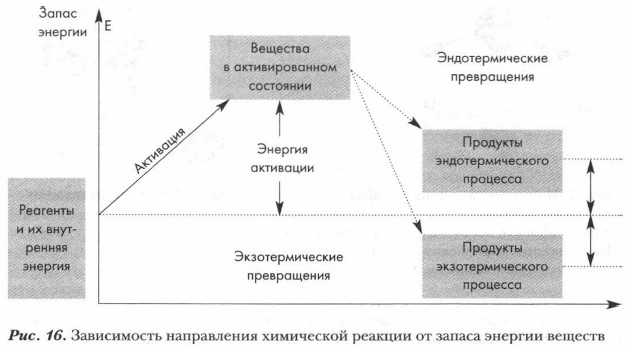
Энергия, необходимая для начала химического взаимодействия, называется энергией активации (рис. 14). Она необходима для осуществления эффективного столкновения молекул, приводящего к взаимодействию. Энергию активации можно определить также как энергию, необходимую для достижения химической системой переходного состояния, называемого активированным комплексом. Чем меньше величина энергии активации, тем выше скорость реакции. Все органические реакции (как и неорганические) сопровождаются изменением энергии химической системы. Энергия химической реакции в целом — это энергия, которая выделяется или поглощается в результате реакции. Из курса 8 класса вы уже знаете, что количество выделенного или поглощенного в ходе реакции тепла называется тепловым эффектом химической реакции (рис. 15).
Вы знаете также, что реакции, протекающие с выделением теплоты, называются экзотермическими (+Q), а реакции, протекающие с поглощением теплоты, — эндотермическими (-Q). Химическое уравнение, в котором указывается тепловой эффект, называется термохимическим. Задание. Рассмотрите схему (рис. 16) и прокомментируйте ее содержание, используя ваши знания об энергетике химической реакции.
Изменять реакционную способность и в первую очередь энергетическое состояние конкретного вещества можно различными путями:
Многие органические реакции являются каталитическими, т. е. протекают в присутствии катализаторов. Задание. Задания. Приведите примеры различных видов катализа и раскройте их различия. Какие вещества называют ингибиторами? Приведите пример реакции с их участием.
|
|
|



 Скорость гомогенной реакции можно выразить формулой: υгомог = ΔС/Δt, где С — концентрация, t — время. Скорость гетерогенной реакции вычисляется сложнее, так как она определяется числом молей вещества, вступивших в реакцию или образующихся в результате реакции в единицу времени на единицу поверхности раздела фазы. Скорость гетерогенной реакции υгетерог = Δn/SΔt, где n — количество вещества (моль), S — площадь поверхности, t — время.
Скорость гомогенной реакции можно выразить формулой: υгомог = ΔС/Δt, где С — концентрация, t — время. Скорость гетерогенной реакции вычисляется сложнее, так как она определяется числом молей вещества, вступивших в реакцию или образующихся в результате реакции в единицу времени на единицу поверхности раздела фазы. Скорость гетерогенной реакции υгетерог = Δn/SΔt, где n — количество вещества (моль), S — площадь поверхности, t — время.