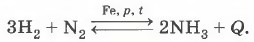|
|
|
|
|
Глава вторая. Химические реакции § 16. Обратимость химической реакции. Химическое равновесие и способы его смещения (продолжение)Этот принцип можно было бы назвать принципом «делай наоборот и добьёшься своего». Рассмотрим, как нужно поступить, чтобы сместить равновесие, если изменять каждое из условий реакции, на примере реакции синтеза аммиака:
Вначале дадим характеристику этого процесса. 1. Прямая реакция является реакцией соединения, так как из двух простых веществ — азота и водорода — образуется одно сложное вещество — аммиак. Разумеется, обратная реакция по этому признаку относится к реакциям разложения. 2. Так как обе реакции — и прямая, и обратная — протекают в присутствии катализатора (им может служить или универсальная, но дорогая платина, или дешёвый железный катализатор с добавками оксидов калия и алюминия), то обе реакции являются каталитическими. Следует отметить, что катализатор не влияет на смещение равновесия, он одинаково изменяет скорость как прямой, так и обратной реакций, т. е. только ускоряет момент наступления химического равновесия. 3. Прямая реакция протекает с выделением теплоты, поэтому относится к экзотермическим реакциям. Логично поэтому утверждать, что обратная реакция является эндотермической и протекает с поглощением теплоты. Итак, рассмотрим теперь, как применяется принцип Ле Шателье, принцип противодействия, для смещения равновесия реакции синтеза аммиака. 1. Изменение равновесных концентраций, т. е. концентраций веществ после установления равновесия. Чтобы сместить равновесие в сторону образования аммиака, необходимо увеличить концентрацию исходных веществ, т. е. концентрацию азота и водорода, и уменьшить концентрацию продукта, т. е. аммиака. Равновесные концентрации принято обозначать квадратными скобками, в отличие от неравновесных, которые обозначают буквой С. Следовательно, чтобы сместить равновесие рассматриваемой реакции вправо, нужно увеличить концентрации азота и водорода ([N2] и [Н2]) и уменьшить концентрацию аммиака ([NH3]), т. е. вывести его из сферы реакции. Понятно, что для смещения равновесия влево нужно поступить наоборот. 2. Изменение давления. Синтез аммиака из водорода и азота сопровождается уменьшением объёма: из 4 моль исходных веществ образуется только 2 моль аммиака. Очевидно, что в закрытом сосуде или аппарате (он называется колонной синтеза) (рис. 106) продукты этой реакции создают меньшее давление, чем создавали сходные вещества. Значит, прямая реакция — синтез аммиака — сопровождается понижением давления. Наоборот, разложение аммиака на водород и азот ведёт к увеличению числа молекул газов, а следовательно, и к увеличению давления. При сжатии реакционной смеси равновесие смещается вправо, в сторону образования аммиака, так как этот процесс приводит к уменьшению давления, т. е. противодействует внешнему воздействию. Наоборот, уменьшение давления смещает равновесие влево, в направлении разложения аммиака.
Необходимо отметить, что изменение давления смещает равновесие лишь в том случае, если в реакции принимают участие газообразные вещества и она сопровождается изменением их количества. Если же количество газообразных веществ в процессе реакции не изменяется, то увеличение или уменьшение давления не влияет на равновесие такой обратимой реакции. Например, в реакции синтеза оксида азота (II) общее количество вещества исходных газов N2 и 02 равно количеству вещества продукта NO (по 2 моль). Поэтому изменение давления не нарушает равновесие этой реакции. 3. Изменение температуры. Мы уже выяснили, что процесс образования аммиака из водорода и азота является экзотермическим, а обратный — разложение аммиака — эндотермическим. При повышении температуры равновесие этой реакции сместится влево, в направлении реакции разложения аммиака, которая проходит с поглощением теплоты и поэтому ослабляется внешним воздействием — повышением температуры. Наоборот, охлаждение реакционной смеси смещает равновесие вправо, в направлении реакции синтеза аммиака. Эта реакция идёт с выделением теплоты и противодействует охлаждению.
|
|
|