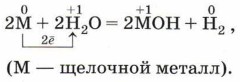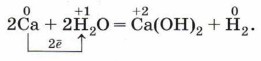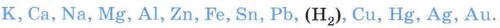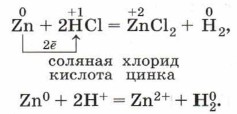|
|
|
|
|
Глава третья. Вещества и их свойства § 20. Металлы (продолжение)Взаимодействие металлов с водой
При обычных условиях энергично взаимодействуют с водой щелочные и щёлочноземельные металлы, при этом образуются щёлочь и водород (в полном соответствии с названиями подгрупп). Скорость химической реакции щелочных металлов с водой зависит от природы металла (см. рис. 104). Выделяющийся водород в реакции с литием можно собрать, накрывая металл пробиркой, но ни с натрием, ни с калием подобный опыт проделать нельзя, так как водород выделяется очень активно и может загореться. В этом случае возможен взрыв и выброс щёлочи:
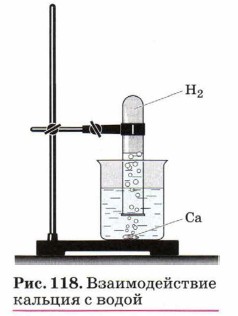
Аналогично можно получить и собрать водород и в реакции кальция с водой (рис. 118):
Взаимодействие металлов с растворами кислотСпособность металлов взаимодействовать с растворами кислот и следующие свойства металлов вытекают из их положения в электрохимическом ряду напряжений:
Металлы взаимодействуют с растворами кислот при соблюдении ряда условий: • металл должен находиться в ряду напряжений левее водорода; • в результате реакции должна образоваться растворимая соль, так как в противном случае она покроет металл осадком и доступ кислоты к металлу прекратится; • для этих реакций не рекомендуется использовать щелочные металлы (почему?); • по-особому взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации. Например, хорошо знакомая вам реакция Г. Кавендиша, которую мы описываем ранее:
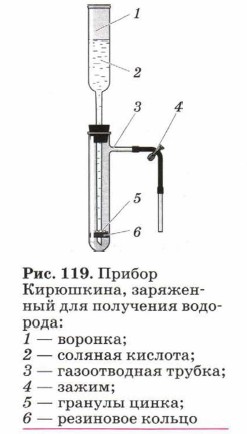
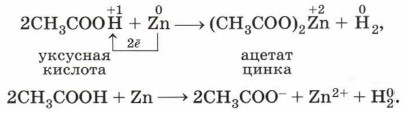
Для получения водорода по этой реакции рациональнее использовать не аппарат Киппа, а прибор Кирюшкина (рис. 119). Аналогично протекает реакция металлов и с органическими кислотами:
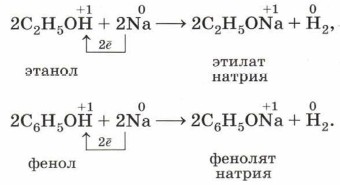
Некоторые органические соединения проявляют слабые кислотные свойства, а потому взаимодействуют с щелочными металлами:
|
|
|