|
|
|
|
|
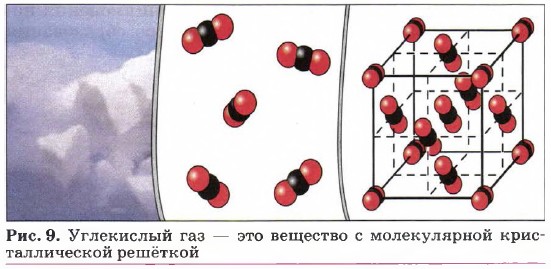
Глава первая. Углеводороды и их природные источники § 4. Ковалентная химическая связь (продолжение)Классифицировать ковалентную связь можно: 1) по механизму образования — обменный и донорно-акцепторный; 2) по полярности связи — ковалентные неполярные и ковалентные полярные связи; 3) по кратности — одинарные, двойные и тройные ковалентные связи. Так как результатом образования ковалентных связей является возникновение молекул, а такая связь преобладает в химическом мире, то огромное количество веществ имеют молекулярное строение. Это почти все органические соединения, все газы, подавляющее большинство жидкостей и многие твёрдые вещества. Однако и газы, и жидкости при определённых условиях (высоком давлении, низкой температуре) можно перевести в твёрдое кристаллическое состояние. Для веществ с ковалентной связью характерны два типа кристаллических решёток — молекулярные и атомные. В узлах молекулярных кристаллических решёток располагаются молекулы, образованные за счёт прочных ковалентных связей. Между молекулами действуют слабые силы межмолекулярного притяжения (их называют ван-дер-ваальсовыми), а потому вещества с молекулярными кристаллическими решётками непрочные, легкоплавкие, летучие. Молекулярные кристаллические решётки имеют газы и жидкости в твёрдом состоянии, кристаллический иод, сера, белый фосфор, углекислый газ (рис. 9), большинство органических соединений.
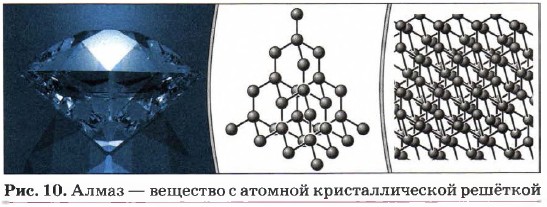
За счёт ковалентных связей могут быть образованы вещества не только молекулярного, но и атомного строения, т. е. вещества с атомной кристаллической решёткой, в узлах которой располагаются отдельные атомы. Примером веществ с таким типом кристаллических решёток могут служить аллотропные модификации углерода, и в первую очередь алмаз (рис. 10). Необычайная твёрдость алмаза по шкале твёрдости веществ (она называется шкалой твёрдости Мооса) оценена самым высоким значением — 10 (рис. 11). Благодаря высокой твёрдости алмаз используют для изготовления шлифовальных инструментов, буров, свёрл, стеклорезов, хотя в сознании большинства людей — это камень ювелиров, использующих отшлифованные алмазы — бриллианты (рис. 12).
Другая аллотропная модификация углерода — графит — несколько противоречит утверждению о том, что вещества с атомной кристаллической решёткой обладают высокой твёрдостью. Графит мягкий, так как имеет слоистую структуру (рис. 13). В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями непрочны, и потому графит мягок. Но, как и алмаз, он тугоплавок. Из графита изготавливают электроды, твёрдые смазки, стержни для карандашей, детали в ядерных реакторах.
|
|
|