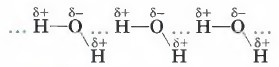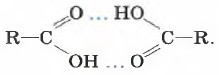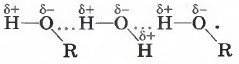|
|
|
|
|
Глава первая. Углеводороды и их природные источники § 6. Водородная химическая связьРассмотрением водородной связи мы завершаем наше знакомство с типами химической связи. И это не случайно. Во-первых, водородная связь — это частный случай межмолекулярного взаимодействия. Энергия такой связи примерно в 10 раз меньше, чем ковалентных и ионных химических связей, и составляет всего лишь 4—40 кДж/моль, т. е. вписывается в энергетическую характеристику межмолекулярных сил. Во-вторых, рассмотрение водородной связи позволит сравнить эту химическую связь с другими типами и тем самым обобщить наши представления о природе химической связи вообще. В-третьих, это самая значимая на нашей планете химическая связь, ибо она определяет структуру соединений, которые являются носителями жизни на Земле (белки и нуклеиновые кислоты), отвечают за хранение и воспроизведение наследственной информации живых организмов. Все рассмотренные ранее типы химической связи (вспомните какие) имеют названия, в основу которых положены следующие химические понятия: «ионы», «атомы», «металлы». А водородная связь — специфический термин, связанный с конкретным химическим элементом — водородом. Очевидно, это связано с особенностью строения атома водорода, имеющего один- единственный валентный электрон. Участвуя в образовании химической связи, этот электрон обнажает крохотное ядро атома водорода, представляющее собой не что иное, как обыкновенный протон.
Образованием межмолекулярной водородной связи объясняется тот факт, что даже вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода; спирты — метанол, этанол, пропанол; карбоновые кислоты — муравьиная, уксусная) или легко сжижаемые газы (аммиак, фтороводород). Механизм образования водородной связи состоит в электростатическом притяжении атома водорода, имеющего частичный положительный заряд, и атома кислорода (фтора или азота), имеющего частичный отрицательный заряд. В образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободными орбиталями атомов водорода и неподелён- ными электронными парами атомов кислорода (фтора или азота). Например, вода ассоциирована в жидкость за счёт водородных связей, возникающих между молекулами-диполями.
В жидкой воде образуются водородные связи между множеством молекул. А вот молекулы карбоновых кислот наиболее устойчивы в виде димеров, также образованных водородными связями:
Алхимическое правило растворения «подобного в подобном» объясняется образованием водородной связи между молекулами растворителя и молекулами растворённого вещества. Так, метиловый и этиловый спирты, этиленгликоль и глицерин, уксусная и муравьиная кислоты неограниченно растворяются в воде, например:
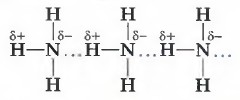
Способность некоторых газов, например аммиака, за счёт образования водородных связей
легко сжижаться (при давлении 0,9 МПа и комнатной температуре) и вновь переходить в газообразное состояние с поглощением теплоты позволяет использовать их в качестве хладагентов в промышленных холодильных установках (рис. 30).
|
|
|