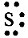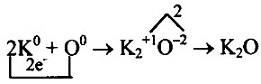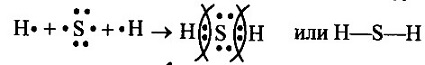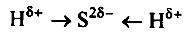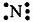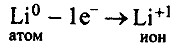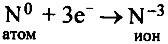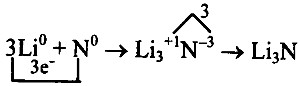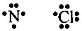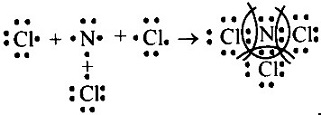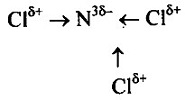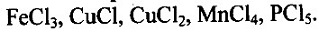|
|
|
|
|
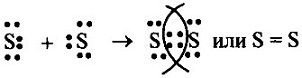
Глава первая. Атомы химических элементов Ковалентная полярная химическая связь. ОтветыОтвет на вопрос 1Так как значения ЭО водорода и фосфора одинаковы, то химическая связь в молекуле РН3 будет ковалентной неполярной. Ответ на вопрос 21. а) в молекуле S2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи будет следующей: Сера— элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке. Непарных электронов будет: 8 - 6 = 2. Обозначим внешние электроны
б) в молекуле К2O связь ионная, т.к. она образована атомами элементов металла и неметалла. Калий — элемент I группы главной подгруппы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
Кислород— элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, которых не хватает до завершения уровня, чем отдать 6 электронов:
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2 • 1). Чтобы атомы калия отдали 2 электрона, их нужно взять 2, чтобы атомы кислорода смогли принять 2 электрона, необходим только 1 атом:
в) в молекуле H2S связь ковалентная полярная, т.к. она образована атомами элементов с различной ЭО. Схема образования связи будет следующей: Сера— элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке. Непарных электронов будет: 8 - 6 = 2. Водород— элемент главной подгруппы I группы. Его атомы содержат по 1 электрону на внешней оболочке. Непарным является 1 электрон (для атома водорода завершенным является двухэлектронный уровень). Обозначим внешние электроны:
Общие электронные пары смещены к атому серы, как более электроотрицательному
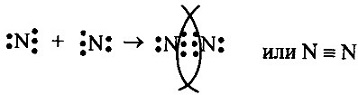
1. а) в молекуле N2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи следующая: Азот— элемент главной подгруппы V группы. Его атомы имеют 5 электронов на внешней оболочке. Непарных электронов: 8 — 5 = 3. Обозначим внешние электроны:
б) в молекуле Li3N связь ионная, т.к. она образована атомами элементов металла и неметалла. Литий — элемент главной подгруппы I группы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
Азот — элемент главной подгруппы V группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3 • 1). Чтобы атомы лития отдали 3 электрона, необходимо 3 атома, чтобы атомы азота смогли принять 3 электрона, необходим только один атом:
в) в молекуле NCl3 связь ковалентная полярная, т.к. она образована атомами элементов-неметаллов с различными значениями ЭО. Схема образования связи следующая: Азот — элемент главной подгруппы V группы. Его атомы имеют по 5 электронов на внешней оболочке. Непарных электронов будет: 8 - 5 = 3. Хлор— элемент главной подгруппы VII группы. Его атомы содержат по 7 электронов на внешней оболочке. Непарным остается 1 электрон. Обозначим внешние электроны:
Общие электронные пары смещены к атому азота, как более электроотрицательному:
Ответ в вопрос 3Связь в молекуле НСl менее полярна, чем в молекуле HF, т.к. в ряду изменения ЭО хлор и водород менее удалены друг от друга, чем фтор и водород. Ответ на вопрос 4Ковалентная химическая связь образуется за счет обобщения внешних электронов. По числу общих электронных пар она бывает одинарной, двойной или тройной. По ЭО ковалентная связь делится на полярную и неполярную. Ответ на вопрос 5
Ответ на вопрос 6
|
|
|