|
|
|
|
|
Глава третья. Соединения химических элементов § 22. Соли
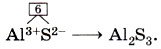
Как видно из определения, соли по составу похожи на кислоты, только вместо атомов водорода они содержат ионы металла. Поэтому их можно также назвать продуктами замещения атомов водорода в кислоте на ионы металла. Например, всем известная поваренная соль NaCl может быть рассмотрена как продукт замещения водорода в соляной кислоте НСl на ион натрия. Заряд иона натрия 1+, а заряд иона хлора 1 - . Так как соединение электронейтрально, формула поваренной соли Na+Cl-. Если же надо вывести формулу сульфида алюминия (III), поступают следующим образом. 1. Обозначают заряды ионов, из которых состоит соединение: Al3+S2. Заряд иона алюминия 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты H2S, он равен 2-. 2. Находят наименьшее общее кратное числовых значений зарядов ионов алюминия и серы (3 и 2), оно равно 6. 3. Находят индексы, разделив наименьшее общее кратное на величины зарядов, и записывают формулу:
Аналогично выводят формулы солей кислородсодержащих кислот, имеющих сложные ионы. Выведем, например, формулу кальциевой соли фосфорной кислоты — фосфата кальция. По таблице Менделеева определим заряд иона кальция как элемента главной подгруппы II группы (IIА группы): 2+. По формуле фосфорной кислоты Н3РO4 определим заряд иона, образованного кислотным остатком:
(читают «кальций три, пэ-о-четыре дважды»). Нетрудно заметить, что при выведении формул солей по зарядам ионов вы должны действовать так же, как при выведении формул бинарных соединений по валентности и по степеням окисления образующих их элементов. Как образуют названия солей бескислородных кислот, вы уже рассмотрели, когда знакомились с номенклатурой бинарных соединений: соли НСl называют хлоридами, а соли H2S — сульфидами. Названия солей кислородсодержащих кислот составляют из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляют, в свою очередь, из корней названий элементов, с суффиксами -am для высшей степени окисления и -ит для низшей степени окисления атомов элемента-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты HNO3 называют нитратами: KNO3 — нитрат калия, а соли азотистой кислоты HNO2 — нитритами: Ca(NO2)2 — нитрит кальция. Если же металл проявляет различные степени окисления, то их указывают в скобках римской цифрой, например: Fe2+SO3 — сульфит железа (II) и Номенклатура солей приведена в таблице 5. По растворимости в воде соли делят на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Для определения растворимости солей используют таблицу растворимости кислот, оснований и солей в воде. Если под рукой нет этой таблицы, можно воспользоваться приведёнными ниже правилами. Их легко запомнить. 1. Растворимы все соли азотной кислоты — нитраты. 2. Растворимы все соли соляной кислоты — хлориды, кроме AgCl (Н), РЬСl2 (М). 3. Растворимы все соли серной кислоты — сульфаты, кроме BaSO4 (Н), PbSO4 (Н), CaSO4 (М), Ag2SO4 (М). 4. Растворимы соли натрия и калия. 5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и К+.
|
|
|




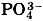 . Отсюда формула фосфата кальция имеет вид
. Отсюда формула фосфата кальция имеет вид
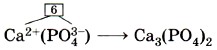
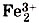 (SO4)3 — сульфат железа (III).
(SO4)3 — сульфат железа (III).