|
|
|
|
|
Глава третья. Соединения химических элементов Кристаллические решётки
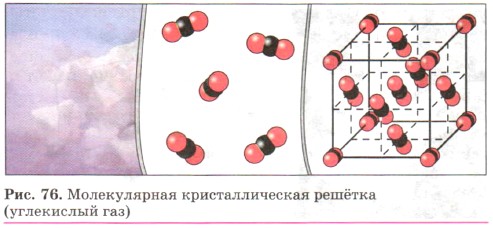
кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Сl-, образующих решётку в форме куба (рис. 72). Связи между ионами в таком кристалле очень прочны. Поэтому вещества с ионной решёткой обладают сравнительно высокой твёрдостью и прочностью, они тугоплавки и нелетучи. Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы. В таких решётках атомы соединены между собой очень прочными ковалентными связями. Такой тип кристаллической решётки имеет алмаз (рис. 73) — одно из аллотропных видоизменений углерода. Огранённые и отшлифованные алмазы называют бриллиантами. Их широко применяют в ювелирном деле (рис. 74). К веществам с атомной кристаллической решёткой относятся кристаллические бор, кремний и германий, а также сложные вещества, например такие, как кремнезем, кварц, песок, горный хрусталь, в состав которых входит оксид кремния (IV) SiO2 (рис. 75). Большинство веществ с атомной кристаллической решёткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С, у кремния — 1415 °С, у кремнезёма — 1728 °С), они прочны и тверды, практически нерастворимы. Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и ковалентными полярными (хлороводород НСl, вода Н2O), и ковалентными неполярными (азот N2, озон O3).
Несмотря на то что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решётками имеют малую твёрдость, низкие температуры плавления, летучи. Примерами веществ с молекулярными кристаллическими решётками являются твёрдая вода — лёд, твёрдый оксид углерода (IV) СO2 — «сухой лёд» (рис. 76), твёрдые хлороводород НСl и сероводород H2S, твёрдые простые вещества, образованные одно- (благородные газы: гелий, неон, аргон, криптон), двух- (водород Н2, кислород O2, хлор Сl2, азот N2, иод I2), трёх- (озон O3), четырёх- (белый фосфор Р4), восьмиатомными (сера S8) молекулами. Большинство твёрдых органических соединений имеют молекулярные кристаллические решётки (нафталин, глюкоза, сахар).
|
|
|