|
|
|
|
|
Глава четвёртая. Изменения, происходящие с веществами § 28. Химические уравненияЗакон сохранения массы веществ, открытый М. В. Ломоносовым в 1748 г., гласит:
Материальными носителями массы веществ являются атомы химических элементов, из которых состоят как вступившие в реакцию вещества (реагенты), так и образовавшиеся в результате её новые вещества (продукты реакции). Поскольку при химических реакциях атомы не образуются и не разрушаются, а происходит лишь их перегруппировка, то становится очевидным справедливость открытого М. В. Ломоносовым и подтверждённого позднее А. Лавуазье закона. В справедливости закона сохранения массы веществ можно легко убедиться на простом опыте.
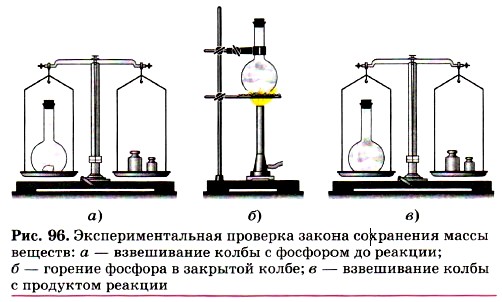
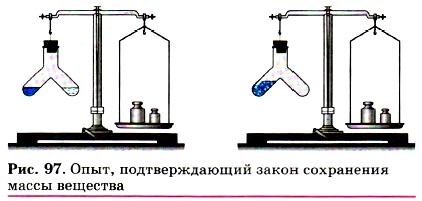
Поместим в колбу немного красного фосфора, закроем её пробкой и взвесим на весах (рис. 96). Затем колбу осторожно нагреем. О том, что произошла химическая реакция, можно определить по появлению в колбе густого белого дыма, состоящего из оксида фосфора (V), который образовался при взаимодействии фосфора с кислородом. При повторном взвешивании колбы с продуктами этой реакции мы убедимся, что масса веществ в колбе не изменилась, хотя и произошло превращение фосфора в его оксид. Этот же вывод будет нами сделан и при проведении ещё одного простого, но очень наглядного опыта. В специальный сосуд нальём отдельно соляную кислоту и раствор щёлочи, например гидроксида натрия (рис. 97). К раствору щёлочи добавим несколько капель индикатора — фенолфталеина, отчего раствор окрасится в малиновый цвет. Закроем прибор пробкой, уравновесим гирями на весах, отметим массу, а затем сольём растворы. Малиновая окраска исчезнет, потому что кислота и щёлочь прореагировали друг с другом. Масса же сосуда с полученными продуктами реакции не изменилась.
Аналогичное наблюдение сделал и автор закона сохранения массы веществ М. В. Ломоносов, который проводил опыты в запаянных стеклянных сосудах, «дабы исследовать, прибывает ли вес металла от чистого жару», и обнаружил, что «без пропущения внешнего воздуха вес металлов остаётся в одной мере». На основании этого закона пишут химические предложения, т. е. составляют уравнения химических реакций с помощью химических слов — формул.
В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы (формулу) образующихся веществ, также соединённых знаком «плюс». Между частями уравнения ставят стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
|
|
|