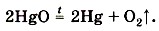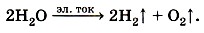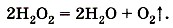|
|
|
|
|
Глава четвёртая. Изменения, происходящие с веществами § 30. Реакции разложенияВ окружающем мире и внутри нас ежесекундно протекают миллионы реакций. Получить представление о них нам помогает классификация реакций. С одной из классификаций — «по признаку поглощения или выделения теплоты» — мы уже познакомились. Рассмотрим ещё одну классификацию реакций — «по числу и составу исходных веществ и продуктов реакции».
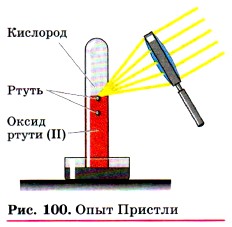
Познакомимся с реакциями разложения. Обратимся к истории химии. В 1774 г. английский химик Дж. Пристли, используя стеклянную двояковыпуклую линзу (большое увеличительное стекло), направил сконцентрированный ею пучок солнечных лучей на оксид ртути (II) и получил кислород (рис. 100). Чтобы подчеркнуть, что кислород — это газ, в уравнении реакции рядом с его формулой записывают стрелку, направленную вверх:
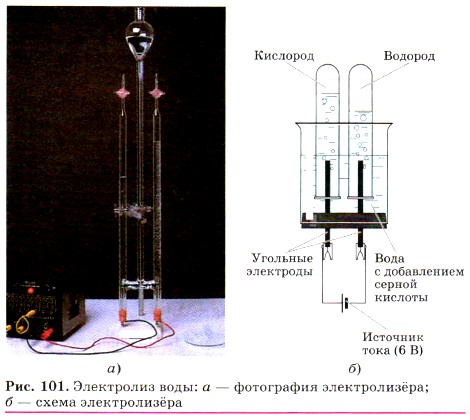
Обратите внимание на следующий признак этой реакции разложения — в неё вступает одно сложное вещество, а образуются два новых простых вещества. Рассмотрим другую аналогичную реакцию: разложение воды электрическим током с помощью специальной установки — электролизёра (рис. 101):
Этот процесс служит одним из способов получения чистого кислорода. Однако в лабораторной практике кислород часто получают разложением другого вещества — пероксида водорода Н2O2 (в обиходе его часто называют перекисью водорода):
Если подогревать некоторый объём пероксида водорода в пробирке, не доводя его до кипения, то кислород выделяется медленно и его будет недостаточно, чтобы увидеть, как вспыхнет внесённая в верхнюю часть пробирки тлеющая лучинка. В этом случае говорят, что химическая реакция идёт с небольшой скоростью. Можно ли увеличить скорость химической реакции?
Нальём в химический стакан на 1/3 его объёма купленного в аптеке пероксида водорода и с помощью ложечки аккуратно всыпем в него немного порошка оксида марганца (IV) (рис. 102, а). Жидкость в стакане мгновенно «вскипает» от бурно выделяющегося кислорода
(рис. 102, б). Внесённая в верхнюю часть стакана тлеющая лучинка ярко вспыхивает, доказывая наличие кислорода (рис. 102, в). В этом случае говорят о том, что реакция протекает с большой скоростью. Следовательно, скорость химической реакции — это быстрота её протекания, т. е. быстрота превращения одних веществ в другие. Мы научились управлять скоростью химической реакции разложения пероксида водорода, и помог нам в этом оксид марганца (IV) — катализатор этой реакции.
По окончании химической реакции разложения пероксида водорода ускоривший её протекание оксид марганца (IV) не изменился. Как это можно доказать? Если вылить из химического стакана оставшийся в нём продукт реакции — воду, а затем прилить в него свежую порцию пероксида водорода, то реакция будет протекать снова. Аналогичный процесс вы могли наблюдать, если полученную вами ранку для её обеззараживания обрабатывали перекисью водорода. Бурное выделение кислорода катализируется в этом случае содержащимся в крови биологическим катализатором — ферментом каталазой.
Большинство химических процессов в живых организмах протекают с участием ферментов. Ферменты входят в состав многих стиральных порошков и помогают отстирывать пятна крови, белков, чая и других загрязнителей. С помощью ферментов варят пиво, изготавливают сыры и лекарственные средства. Обратим внимание на признак реакции разложения пероксида водорода — в реакцию вступило одно сложное вещество, а образовались два новых — простое и сложное.
|
|
|