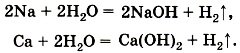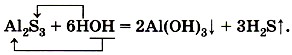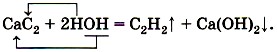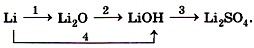|
|
|
|
|
Глава четвёртая. Изменения, происходящие с веществами Типы химических реакций на примере свойств воды
Реакции замещения. Щелочные и щёлочноземельные металлы с водой могут образовывать щёлочи не только с помощью своих оксидов, но и при непосредственном взаимодействии. Только это будут уже реакции другого типа — реакции замещения, например:
Нальём в чашку Петри, находящуюся на столике кодоскопа, немного воды и добавим к ней несколько капель фенолфталеина. Затем поместим в сосуд кусочек очищенного натрия величиной со спичечную головку. На экране будет проецироваться происходящая при этом химическая реакция (рис. 114): кусочек натрия превращается в круглый шарик (плавится, так как реакция экзотермическая), бегает по поверхности воды (натрий легче воды и подталкивается образующимся в результате взаимодействия газообразным водородом), оставляя за собой малиновый след (это изменяет окраску фенолфталеина получившаяся в результате реакции щёлочь — гидроксид натрия). Реакции обмена. Если вы обратите внимание на уже знакомую вам таблицу растворимости гидроксидов и солей в воде, то, очевидно, заметите, что в некоторых клетках этой таблицы стоят прочерки, которые обозначают, что данное вещество в водной среде разлагается, или, как говорят, гидролизуется (гидро — вода, лизос — разложение).
Гидролиз может быть обратимым (с ним вы будете знакомиться при изучении химии в старших классах) и необратимым. Например, необратимо гидролизуется сульфид алюминия:
Если в пробирку прилить на ⅓ её объёма дистиллированной воды, а затем поместить в неё кусочек карбида кальция СаС2 величиной с горошину, то можно заметить выделение газа — ацетилена С2Н2, а если затем в пробирку прилить раствор фенолфталеина, то появление малиновой окраски укажет на образование щёлочи — гидроксида кальция:
Гидролиз органических веществ — жиров, белков и углеводов, протекающий в живых организмах, — это основа их жизнедеятельности. Следовательно, вода — не только самое важное вещество на Земле, но это и многоликое соединение, обладающее разнообразными химическими свойствами.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Закончите уравнения реакций, схемы которых:
Укажите типы реакций по признаку «число и состав исходных веществ и продуктов реакции». Назовите продукты реакций. 2. Какой объём ацетилена (н. у.) образуется в результате гидролиза 320 мг карбида кальция, содержащего 2% примесей? 3. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Укажите типы реакций по признаку числа и состава исходных веществ и продуктов реакции. 4. Вычислите объём (н. у.) водорода, который образуется при взаимодействии 9,2 г натрия, содержащего 2,5% примесей, с водой. Вычислите количество вещества щёлочи, которое получится при этом. 5. Найдите массу глюкозы и объём кислорода (н. у.), образующихся в процессе фотосинтеза, если в реакцию вступило 448 м3 углекислого газа (н. у.). Вычислите количество вещества воды, которое для этого потребовалось. <<< К началу Ответы к § 34 >>>
|
|
|