|
|
|
|
|
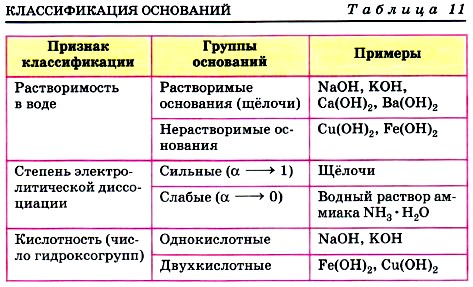
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 40. Основания, их классификация и свойстваРазделение оснований на группы по различным признакам представлено в таблице 11. Все основания, кроме раствора аммиака в воде, представляют собой твёрдые вещества, имеющие различную окраску. Например, гидроксид кальция Са(ОН)2 белого цвета, гидроксид меди (II) Си(ОН)2 голубого цвета, гидроксид никеля (II) Ni(OH)2 зелёного цвета, гидроксид железа (III) Fe(OH)3 красно-бурого цвета и т. д. Водный раствор аммиака NH3 • Н2O , в отличие от других оснований, содержит не катионы металла,
а сложный однозарядный катион аммония
Однако, какими бы разными ни были основания, все они состоят из ионов металла и гидроксогрупп, число которых равно степени окисления металла. Все основания, и в первую очередь щёлочи (сильные электролиты), образуют при диссоциации гидроксидионы ОН-, которые и обусловливают ряд общих свойств: мылкость на ощупь, изменение окраски индикаторов (лакмуса, метилового оранжевого и фенолфталеина), взаимодействие с другими веществами.
Первая реакция (универсальная) была рассмотрена в §38.
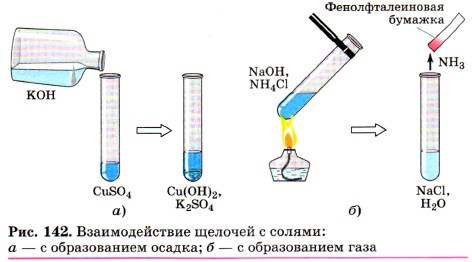
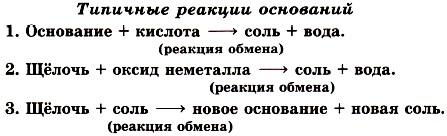
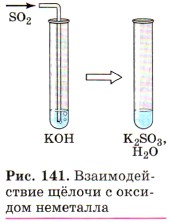
Вторая реакция протекает между щелочами и оксидами неметаллов, которым соответствуют кислоты, например, a) б)
|
|
|



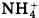 и существует только в растворе (этот раствор вам известен под названием нашатырного спирта). Он легко разлагается на аммиак и воду:
и существует только в растворе (этот раствор вам известен под названием нашатырного спирта). Он легко разлагается на аммиак и воду:
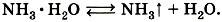

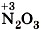 соответствует
соответствует 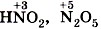 —
— 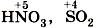 —
— 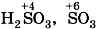 —
— 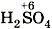 и т.д. При взаимодействии оксидов с основаниями образуются соли соответствующих кислот и вода:
и т.д. При взаимодействии оксидов с основаниями образуются соли соответствующих кислот и вода:
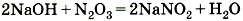
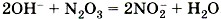 ;
;
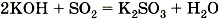 (рис. 141)
(рис. 141)
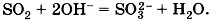 .
.