|
|
|
|
|
Глава пятая. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции § 41. Оксиды, их классификация и свойстваПонятие «оксиды» включает бесконечное разнообразие веществ: жидкие, например оксид водорода, или вода; твёрдые, например оксид кремния (IV) — песок и множество разновидностей кварца, среди которых халцедон и аметист, горный хрусталь и морион; газообразные, например оксиды углерода (IV) и (II) — углекислый и угарный газы. По своим химическим свойствам все оксиды подразделяют на солеобразующие и несолеобразующие.
Несолеобразующих оксидов немного. В их состав входят элементы-неметаллы, например: оксиды азота (I) и (II) — N2O и NO,
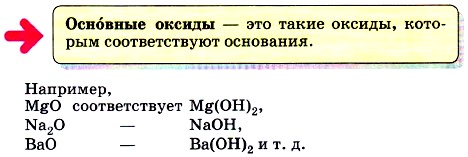
Среди солеобразующих оксидов различают оксиды основные, кислотные и амфотерные. С последними вы будете знакомиться в 9 классе.
К основным оксидам относят оксиды металлов с небольшими степенями окисления (+1 и +2), т. е. оксиды металлов IA и IIA группы Периодической системы Д. И. Менделеева, HgO, МnО и некоторые другие. Все основные оксиды представляют собой твёрдые вещества.
Эта реакция протекает только в том случае, если образуется растворимое основание — щёлочь, поэтому CuO + Н2O ≠, так как Сu(ОН)2 — нерастворим.
|
|
|