|
|
|
|
|
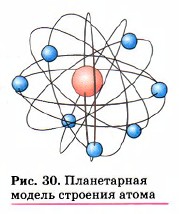
Глава первая. Атомы химических элементов § 7. Основные сведения о строении атомовВы уже знаете, что любой химический элемент, как правило, может существовать в трёх формах: свободные атомы, простые вещества и сложные вещества. Рассмотрим первую форму — свободные атомы. Понятие «атом» возникло ещё в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый». Открытия, сделанные учёными-физиками, доказали, что атом имеет сложное строение — состоит из более мелких (элементарных) частиц. Как же устроен атом? В 1910 г. в Кембридже, близ Лондона, Эрнест Резер-форд со своими учениками и коллегами изучал рассеивание α-частиц, проходящих через тоненькую золотую фольгу и попадавших на экран. Альфа-частицы обычно чуть отклонялись от первоначального направления, всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг — о чудо! — исследователи заметили, что некоторые α-частицы резко изменяли направление движения, будто наталкивались на какую-то преграду. Разместив экран перед фольгой, Э. Резерфорд сумел обнаружить даже те редчайшие случаи, когда α-частицы, отразившись от атомов золота, летели в обратном направлении. Расчёты показали, что наблюдаемые ими явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 тысяч раз меньше радиуса всего атома, той его области, в которой
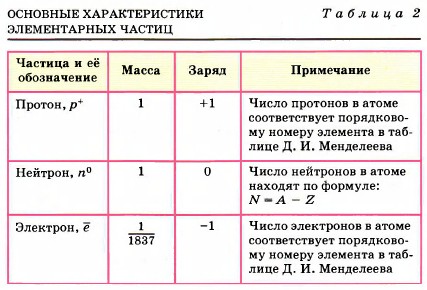
находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, положенному в центр поля. Атом любого химического элемента — как бы крохотная Солнечная система (рис. 30). Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной. Но и это не всё. Оказывается, крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из элементарных частиц двух видов — протонов и нейтронов. Протоны (табл. 2) имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу (она принята в химии за единицу), примерно равную массе атома водорода. Обозначаются протоны знаком
Нейтроны не несут заряда, они нейтральны и имеют массу, примерно равную массе протона, т. е. 1. Обозначают нейтроны знаком Электроны обозначают знаком е. Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Сумму чисел протонов и нейтронов в атоме называют массовым числом (А). Например, массовое число атома алюминия:
|
|
|



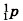 (или р+).
(или р+).
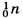 (или n°).
(или n°).
