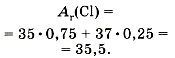|
|
|
|
|
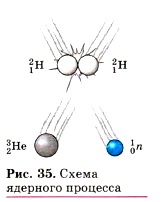
Глава первая. Атомы химических элементов § 8. Изменения в составе ядер атомов химических элементов. ИзотопыИтак, мы выяснили, что атом — мельчайшая частица химического элемента — является сложным образованием природы, построенным из трёх видов элементарных частиц — протонов, нейтронов и электронов. Положение химического элемента в таблице Д. И. Менделеева зависит от величины заряда ядра атома, т. е. от числа протонов в нём. Попробуем представить себе, что будет, если изменить число протонов в ядре, т. е. заряд атомного ядра. Конечно же из исходного элемента получатся совсем другие химические элементы. Такие
процессы называют ядерными (рис. 35), они происходят, например, на Солнце, где ядра атомов водорода соединяются и образуют ядра атомов гелия. Эти процессы протекают с выделением огромного количества энергии, за счёт которой и существует жизнь на Земле. Подобные процессы человек научился проводить и на Земле. Мечта алхимиков о превращении неблагородных элементов в золото стала возможной. Но для протекания этих процессов нужно затратить громадную энергию, и такое золото будет стоить в сотни раз дороже добываемого обычными способами. Если же, не изменяя число протонов в атоме химического элемента, т. е. заряд ядра, изменить число нейтронов, то можно предположить, что положение химического элемента в таблице Д. И. Менделеева не изменится, т. е. из исходного химического элемента не образуется нового химического элемента. Это будет всё тот же химический элемент, но атомы его будут отличаться от исходных своей массой.
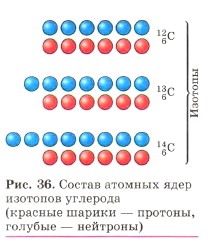
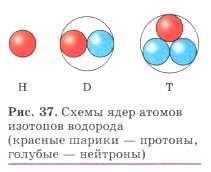
Слово «изотоп» состоит из двух греческих слов: изос— «одинаковый» и топос — «место», обозначает «занимающий одно место» (клетку) в таблице Д. И. Менделеева. Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массовым числом 12, 13 и 14 (рис. 36); кислород — три изотопа с массовым числом 16, 17 и 18 и т. д.
Обычно приводимые в таблице Д. И. Менделеева относительные атомные массы химических элементов являются средним значением атомных масс природной смеси изотопов данного элемента с учётом их относительного содержания в природе, поэтому их значения часто имеют дроб ные значения. Например, атомы природного хлора представляют собой смесь двух изотопов с массой 35
и 37
|
|
|




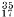 Сl (их в природе 75%)
Сl (их в природе 75%)
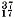 Cl (их 25%); следовательно, относительная атомная масса хлора равна 35,5:
Cl (их 25%); следовательно, относительная атомная масса хлора равна 35,5: