|
|
|
|
|
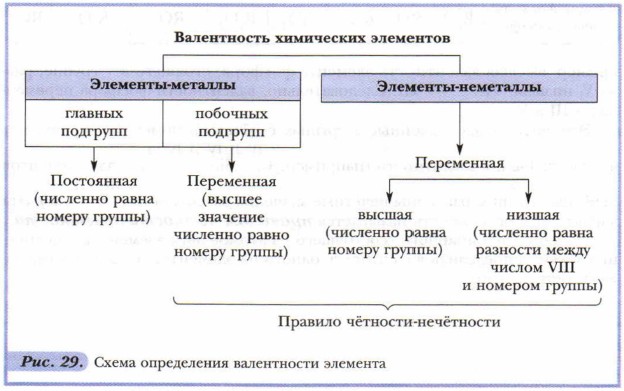
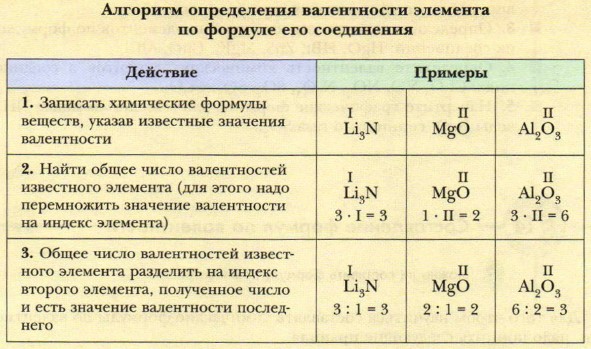
Глава 1. Химические элементы и вещества в свете атомно-молекулярного учения § 13. Валентность химических элементов. Определение валентности в бинарных соединенияхСпособность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов мы будем изучать позднее, научимся определять валентность, исходя из положения элементов в периодической системе (рис. 29, табл. 7).
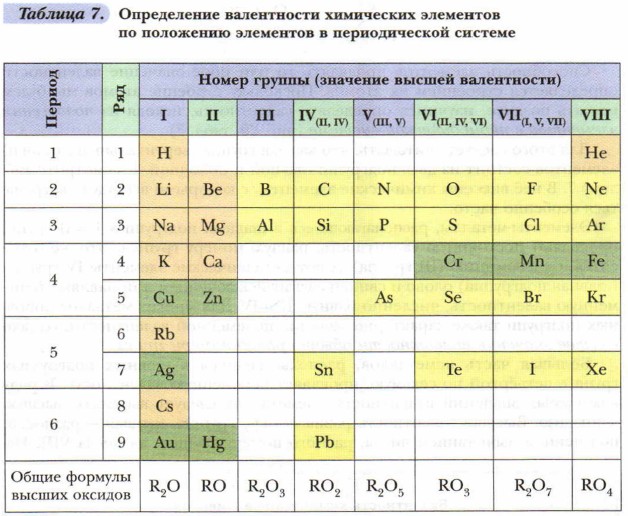
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной и побочной. Рассмотрите таблицу 7. В неё внесены химические элементы, с которыми вы будете встречаться особенно часто. Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную II и IV. Для многих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы! Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая — разности, полученной вычитанием числа, равного номеру группы, из числа МИ. Например: высшая валентность элемента фосфора, стоящего в V группе, равна V, низшая: VIII - V = III. Следовательно, валентность фосфора переменная — III и V. Элементы, расположенные в группах с чётными номерами, проявляют чётные значения валентности По формуле бинарного (состоящего из атомов двух элементов) соединения можно определить валентность одного из элементов, если известна валентность другого.
Выводы 1. Валентность — свойство атомов присоединять определённое число других атомов. 2. В зависимости от строения атомов элементы проявляют постоянную или переменную валентность. 3. Металлы главных подгрупп проявляют постоянную валентность, равную номеру группы. 4. Валентность кислорода и водорода постоянна: 5. В случаях переменной валентности высшее её значение равно номеру группы. 6. Для определения значения низшей валентности элементов-неметаллов следует из числа VIII вычесть номер группы. Основные понятия Валентность: постоянная, переменная • Правило чётности-нечётности Вопросы и задания
|
|
|



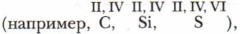 а для элементов нечётных групп характерны нечётные значения валентности
а для элементов нечётных групп характерны нечётные значения валентности 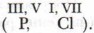 Эта характерная особенность называется правилом чётности-нечётности.
Эта характерная особенность называется правилом чётности-нечётности.
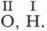
 1. Рассмотрите таблиц) 7. Какие металлы обладают постоянной валентностью? Какие элементы первой группы обладают переменной валентностью? Какую подгруппу они образуют?
1. Рассмотрите таблиц) 7. Какие металлы обладают постоянной валентностью? Какие элементы первой группы обладают переменной валентностью? Какую подгруппу они образуют?
 2. Используя таблицу 7, составьте формулы кислородсодержащих соединений известных вам элементов.
2. Используя таблицу 7, составьте формулы кислородсодержащих соединений известных вам элементов.