|
|
|
|
|
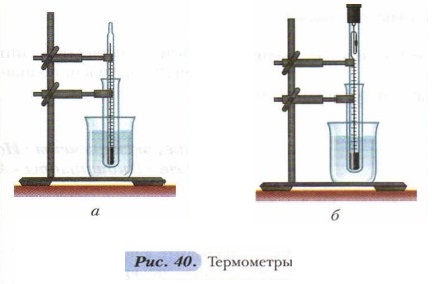
Глава 3. Методы химии Химия — точная наука: Дополнительный материал к § 21Как экспериментальная, так и теоретическая химия имеет дело с измеряемыми величинами. В большинстве случаев эти величины выражены в Международной системе единиц (СИ). Основной принцип построения СИ — простота: в ней никогда не используются лишние единицы, а все необходимые выводятся из семи основных единиц. В химии часто используются производные от этих величин (плотность, объём) и свои специфические величины, когда за эталон сравнения принимаются характерные свойства какого-либо вещества (твёрдость). Надо иметь в виду, что некоторые величины, например давление, энергия и другие, очень долгое время измерялись в химии с помощью других единиц (атмосферы, миллиметры ртутного столба, калории), а не в системе СИ, поэтому эти единицы до сих пор можно встретить в различных справочниках и пособиях. Следует помнить, что всякое измерение ограничено многими факторами: внешними условиями, влияющими на измеряемую величину, точностью прибора, а если речь идёт об исследовательской работе, то и внимательностью наблюдателя. На рисунке 40 изображены термометры: ртутный (a) и термометр Бекмана (б), который позволяет производить измерения с точностью до ±0,002 °С. Поэтому всегда нужно учитывать возможную погрешность измерения. В химии, как в экспериментальной науке, приняты четыре способа выражения зависимости величин:
1) качественный (например, с увеличением атомной массы элементов в группах периодической системы плотность их простых веществ возрастает); 2) количественный (например, при разложении 2 моль воды получается 1 моль кислорода); 3) графический (например, график изменения объёмов реагентов и продуктов при химической реакции); 4) математический (например, m = М • n).
|
|
|