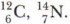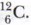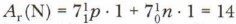|
|
|
|
|
Глава 7. Строение атома § 39. Состав и важнейшие характеристики атома. Изотопы. Химические элементы
В ходе наблюдений и опытов вы познакомились со многими веществами. Вы узнали, что все вещества состоят из связанных между собой атомов. Атом — мельчайшая частица химического элемента, наименьшая часть простых и сложных веществ. Способность атомов образовывать разные химические соединения зависит от их состава и строения. Поэтому необходимо изучить атомы, познать их внутреннюю, невидимую простым глазом природу, чтобы объяснить образование и изменения веществ. Важной предпосылкой для изучения состава и строения атома было открытие явления радиоактивности.
В 1896 г. французский учёный А. Беккерель обнаружил, что атомы химического элемента урана U испускают α-излучение наподобие рентгеновского. В 1898 г. М. Склодовская-Кюри получила из урановой руды два новых радиоактивных металла — полоний Ро и радий Ra. Совместно с П. Кюри она установила, что атомы этих металлов выделяют такие же лучи, как и уран, но более интенсивно. В 1900 г. П. Кюри открыл γ-излучение. Уран, полоний и радий были названы радиоактивными элементами, а само явление излучения — радиоактивностью. Радиоактивность — это свойство атомов некоторых элементов самопроизвольно излучать невидимые глазом частицы; оно обусловлено распадом их атомных ядер, превращением в другие элементы. Этот распад сопровождается излучением трёх видов: α, β и γ.
В современной науке основными элементарными частицами атома признаны: протон, нейтрон, электрон. Остановимся подробнее на составе атома и характеристике этих частиц.
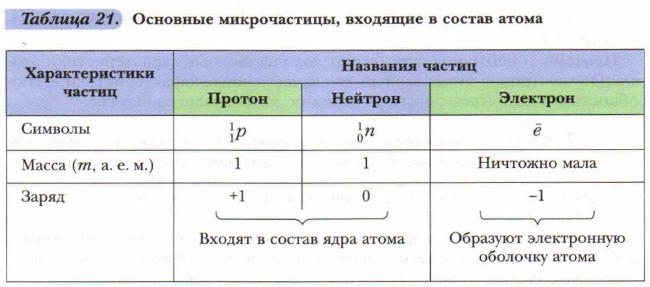
Протоны — это элементарные частицы с массой, приблизительно равной 1, и зарядом +1. Нейтроны — это электронейтральные (незаряженные) частицы ядра атома с массой, равной 1. Электроны — это отрицательно заряженные частицы атома, расположенные вокруг ядра атома. Они образуют электронную оболочку атома. Протоны обозначают символом
Составляющие атом частицы обусловливают его важнейшие характеристики. С некоторыми из них вы уже знакомы (валентность, масса и др.). Заряд ядра — важнейшая характеристика атома и соответствующего ему химического элемента, лежащая в основе его современного определения. Положительный заряд ядра создают его протоны: заряд ядра равен числу протонов в нём. Порядковый (атомный) номер элемента в периодической системе Д.И. Менделеева равен заряду ядра его атомов и обозначается буквой Z. Следовательно, заряд ядра является также важнейшей характеристикой химического элемента.
Другой характеристикой атома, зависимой от протонов и нейтронов ядра, является масса ядра. Она обозначается буквой А и называется массовым числом. Массовое число — это сумма числа протонов и нейтронов в ядре атома. Обе характеристики используются для индексации атома: они ставятся слева от символа элемента, где А — верхний индекс, a Z — нижний индекс, например: Атомной единицей массы (а. е. м.) выступает 1/12 массы атома углерода
Протоны и нейтроны определяют количественные характеристики атомов. От электронов атома зависят его качественные характеристики — способность объединяться с другими атомами, химические свойства.
|
|
|



 Что вы знаете о частицах, образующих атом? Используя знания физики, опишите, кем и какими методами были открыты элементарные частицы атома.
Что вы знаете о частицах, образующих атом? Используя знания физики, опишите, кем и какими методами были открыты элементарные частицы атома.

 Атом состоит из ядра и электронов. Ядро — это часть атома, состоящая из протонов и нейтронов и имеющая положительный заряд. Масса атома определяется массой его протонов и нейтронов.
Атом состоит из ядра и электронов. Ядро — это часть атома, состоящая из протонов и нейтронов и имеющая положительный заряд. Масса атома определяется массой его протонов и нейтронов.
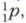 нейтроны —
нейтроны — 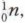 электроны — ё. Изученное можно обобщить в виде таблицы 21.
электроны — ё. Изученное можно обобщить в виде таблицы 21.