|
|
|
|
|
Глава 9. Строение вещества Кристаллическое состояние веществ1. Молекулярные кристаллические решётки — это решётки, в узлах которых расположены молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия. Задание 2. Приведите примеры молекулярных твёрдых веществ. С помощью какой химической связи образованы молекулы этих веществ? На примере льда (Н90), кристаллического иода сделайте вывод о свойствах веществ с молекулярной кристаллической решёткой.
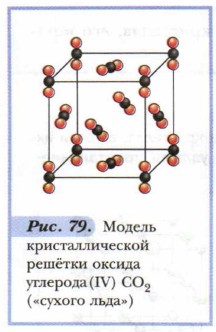
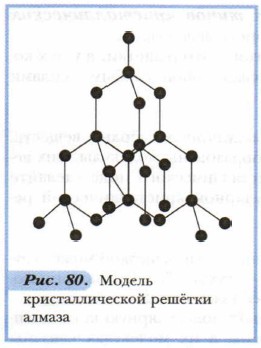
Примером веществ с молекулярной кристаллической решёткой может служить кристаллический оксид углерода (IV) СО2, — «сухой лёд». Рассмотрим модель его кристаллической решётки (рис. 79). В её узлах находятся молекулы. Многие вещества в твёрдом состоянии имеют молекулярную кристаллическую решётку; особенно органические. Атомы в их молекулах связаны прочными ковалентными связями. Молекулы же в кристаллах стянуты слабыми межмолекулярными силами, которые легко разорвать. Поэтому кристаллы с молекулярной решёткой обладают малой твёрдостью, легкоплавки, летучи. Молекулярные вещества легко переходят из одного агрегатного состояния в другое. Примером может служить возгонка иода. 2. Атомные кристаллические решётки — решётки, в которых расположены атомы, стянутые в кристалле прочными ковалентными связями. Атомных кристаллов сравнительно немного. Примерами таких твёрдых веществ служат простые вещества — алмаз, кремний; сложные вещества — карбид кальция, сульфид цинка, диоксид кремния и др. Так, например, кристалл алмаза (рис. 80) имеет форму тетраэдра. Следовательно, структурную его единицу представляет тетраэдр. В центре его ячейки расположен атом углерода, прочно связанный с четырьмя другими атомами углерода с помощью электронных пар. Все связи одинаковы, как и углы, образующиеся между атомами.
Благодаря высокой прочности ковалентной связи атомные кристаллы имеют высокую прочность, они тугоплавки. Температура плавления алмаза +3500 °С. Алмаз — наиболее твёрдое вещество. 3. Ионные кристаллические решётки — это решётки, в узлах которых расположены ионы с противоположными зарядами. Связь между ионами осуществляется за счёт электростатического притяжения. Типичный представитель веществ с такой решёткой — поваренная соль (см. рис. 78). Ионные кристаллические решётки характерны для многих соединений с ионной связью. Это соли, щёлочи. Энергия кристаллических решёток ионных соединений высокая (для NaCl она равна 778 кДж/моль, для CaF2 — 2283 кДж/моль). Ионные кристаллы отличаются высокой твёрдостью и температурой плавления, малой летучестью. По свойствам они сходны с атомными кристаллами. 4. Металлические кристаллические решётки присущи простым веществам — металлам. Подробно они рассматриваются в 9 классе. Выводы 1. Многие простые и сложные вещества имеют кристаллическую структуру. Для них характерны закономерное расположение частиц в трёхмерном пространстве и строгая правильная геометрическая форма кристаллов. 2. Свойства таких веществ зависят не только от строения образующих их атомов и характера их химической связи, но и от кристаллической структуры веществ. Основные понятия Кристалл • Кристаллическая решётка • Типы кристаллических решёток Вопросы и задания
|
|
|



 1. Что такое кристалл и кристаллическая решётка? Каковы её основные характеристики?
1. Что такое кристалл и кристаллическая решётка? Каковы её основные характеристики?
 2. Опишите элементарные ячейки кристаллов фторида кальция, оксида кремния (IV) и льда.
2. Опишите элементарные ячейки кристаллов фторида кальция, оксида кремния (IV) и льда.
 6. Вычислите массу 2 %-го раствора серной кислоты, необходимую для проведения химической реакции с цинком для получения 1,12 л водорода (н. у.).
6. Вычислите массу 2 %-го раствора серной кислоты, необходимую для проведения химической реакции с цинком для получения 1,12 л водорода (н. у.).
 7. На примере твёрдых оксидов углерода (IV) и кремния (IV) установите зависимость их некоторых свойств от кристаллической структуры.
7. На примере твёрдых оксидов углерода (IV) и кремния (IV) установите зависимость их некоторых свойств от кристаллической структуры.