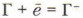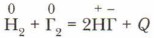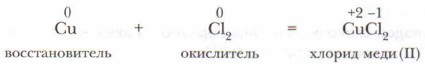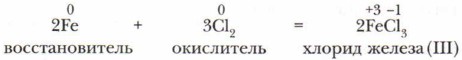|
|
|
|
|
Глава 12. Галогены Строение атомов галогенов. Галогены — простые вещества
Галогены (от греч. hals — «соль» и genes — «рождающий»; буквально — «рождающие соль») — химические элементы главной подгруппы VII группы Периодической системы химических элементов Д.И. Менделеева: фтор — F, хлор — Сl, бром — Вr, иод — I, астат — At. Галогены — элементы, у которых наиболее ярко выражены свойства неметаллов. В свободном виде они в природе не встречаются. Наиболее распространённые минералы, в состав которых входят галогены: CaF2 — флюорит (плавиковый шпат), NaCl — галит (каменная соль), КСl • NaCl — сильвинит, MgCl2 • 6Н2O — бишофит. Бром и иод встречаются в виде соединений в природных водах. Морские водоросли ламинарии — источник получения иода. Астат — радиоактивный элемент. Некоторые сведения о семействе галогенов вам уже знакомы. Задание. Используя знания о галогенах, заполните таблицу. Результаты работы обсудите с товарищем.
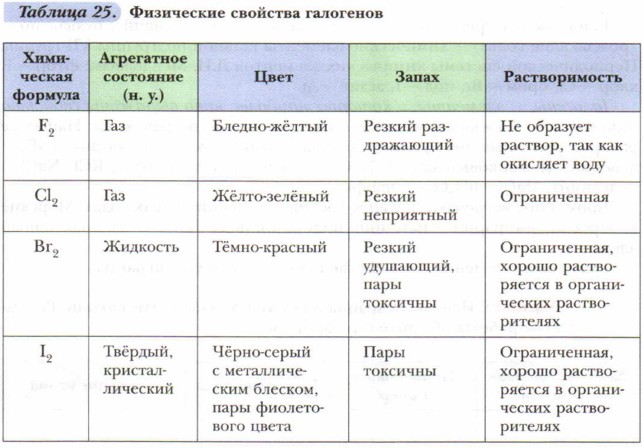
На внешнем энергетическом уровне у всех атомов галогенов по семь электронов. Этим объясняется сходство их свойств. Атомы галогенов легко присоединяют по одному электрону, проявляя в соединениях степень окисления -1. Фтор — самый электроотрицательный элемент, так как обладает наименьшим атомным радиусом и сильнее притягивает к себе электрон. Однако галогены, за исключением фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Галогены — простые веществаЗадание. Запишите формулы молекул галогенов. Определите вид химической связи в молекулах. В свободном состоянии молекулы галогенов состоят из двух атомов. С некоторыми физическими свойствами простых веществ — галогенов вы уже знакомы. Ваши знания дополнит таблица 25.
Водные растворы галогенов называют соответственно хлорной, бромной и йодной водой.
Химические свойства галогеновГалогены — сильные окислители. Атомы галогенов легко присоединяют один электрон, превращаясь в ион:
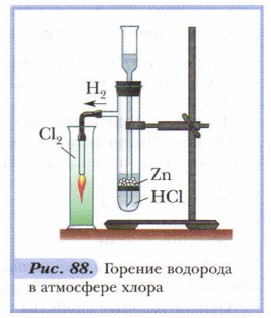
Окислительная способность галогенов увеличивается с уменьшением атомных радиусов. Наиболее сильно неметаллические свойства выражены у фтора. Он является самым электроотрицательным элементом. Галогены реагируют как с простыми, так и со сложиыми веществами. 1. Все галогены взаимодействуют с водородом. Продуктами реакций являются соединения галогенов с водородом — галогеноводороды: фтороводород, хлороводород, бромоводород, иодоводород. Все реакции экзотермические (рис. 88). Общий вид уравнения:
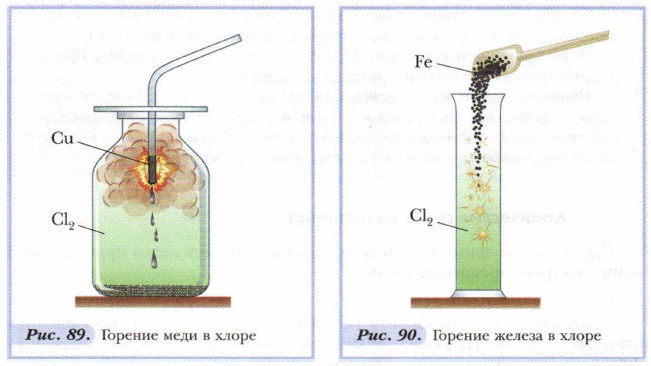
Галогеноводороды хорошо растворяются в воде, образуя кислоты: HF — фтороводородная (плавиковая) кислота, НСl — хлороводородная (соляная) кислота, НВr — бромоводородная кислота, HI — иодоводородная кислота. 2. Галогены активно реагируют с металлами, образуя соли — галогениды: фториды, хлориды, бромиды, иодиды. При повышенной температуре хлор реагирует с медью, железом и некоторыми другими металлами (рис. 89, 90). Металлы в этом случае проявляют высшую степень окисления:
При отсутствии влаги хлор практически не действует на железо, поэтому хлор хранится в стальных баллонах (вода является катализатором этой реакции).
|
|
|



 Назовите элементы, образующие семейство галогенов. Дайте характеристику семейству галогенов.
Назовите элементы, образующие семейство галогенов. Дайте характеристику семейству галогенов.