|
|
|
|
|
Глава 1. Химические элементы и вещества в свете атомно-молекулярного учения § 7. Состав веществ. Закон постоянства состава. Химические формулы
Важнейшей характеристикой вещества является его состав: качественный и количественный. Качественный состав — это перечень всех образующих вещество химических элементов. Количественный состав — эго число атомов каждого элемента в составе мельчайшей частицы вещества — его молекулы.
Состав химических соединений определяют экспериментально с помощью качественного и количественного анализа. Чтобы показать, как на основании данных химического эксперимента делают выводы о составе конкретного вещества, обратимся к примеру.
V(H2) : V(O2) = 2:1 В других специально проведённых опытах установлены массы газов, занимающих объём 1 л: m(Н2) = 0,089 г
Найдём соотношение масс образовавшихся в проведённом опыте веществ: (0,089 • 2) : (1,429 • 1) = 0,178 : 1,429 = 1 : 8 = 2 : 16 Известно, что масса атома кислорода в 16 раз больше, чем масса атома водорода. Следовательно, в молекуле воды на два атома водорода приходится один атом кислорода. Поэтому формула воды — Н2O.
Описать известное несложно. Но в своё время для определения качественного и количественного составов воды учёным пришлось затратить огромные усилия, поставить множество опытов и исправить немало ошибок. Французский химик Жозеф Луи Пруст в период с 1799 по 1806 г. исследовал состав ряда химических соединений. Он установил, что многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав. Это положение получило название закон постоянства состава.
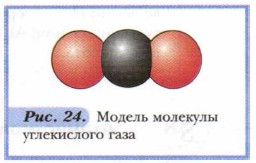
Это означало, например, что все молекулы углекислого газа, содержащегося в воздухе классной комнаты или леса, а также образующего брикет сухого льда, которым охлаждают мороженое, или газа, полученного при прокаливании известняка либо гашении соды уксусом, всегда имеют один и тот же состав. Каждая молекула образована атомом углерода и связанными с ним двумя атомами кислорода (рис. 24). Позже было обнаружено, что данный закон распространяется далеко не на все химические соединения и область его применения не столь широка. Однако в начале XIX в. он сыграл в науке весьма важную роль, поскольку создал теоретическую основу для выражения состава веществ с помощью химических формул. Например: СН4, Н2O, СО2, НСl, H2SO4. Возможно, вы уже заметили, что количественный состав веществ в химических формулах выражен с помощью индексов. Индексом называется цифра (справа внизу около химического знака), обозначающая число атомов каждого химического элемента, входящих в состав молекулы — мельчайшей частицы вещества (рис. 25).
При прочтении химических формул индексы называют. Например, формулу молекулы метана СН4 следует читать так: «це-аш-четыре»; формулу серной кислоты H2SO4 — «аш-два-эс-о-четыре». Основные понятия Закон постоянства состава • Качественный, количественный состав • Индекс • Химическая формула Вопросы и задания
|
|
|



 Какие науки используют формулы? Какие формулы вы знаете?
Какие науки используют формулы? Какие формулы вы знаете?
 Запись, выражающая качественный и количественный состав У вещества с помощью химических знаков, называется химической формулой.
Запись, выражающая качественный и количественный состав У вещества с помощью химических знаков, называется химической формулой.
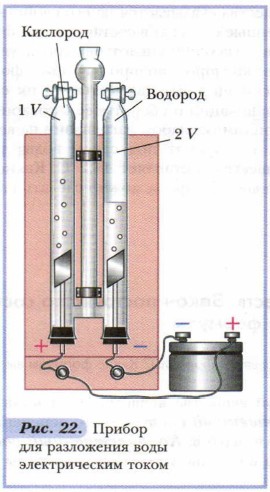
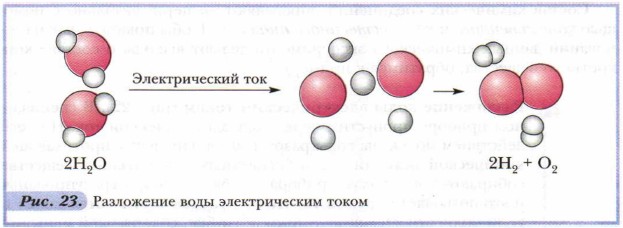
 Разложение воды электрическим током (рис. 22). В специальном приборе пропустим через воду электрический ток. Под его действием молекулы воды разрушаются. Продукты протекающей химической реакции — два бесцветных газообразных вещества собираются в трубках прибора. Трубки прибора градуированы, и это позволяет определить, что объёмы газов относятся как 2:1. Если поднести тлеющую лучинку к трубке, содержащей меньший объём газа, и открыть кран, лучинка ярко вспыхнет: один из неизвестных газов оказывается кислородом. При проверке другого газа горящей лучинкой раздаётся негромкий хлопок. Так сгорает водород. Следовательно, при разложении воды электрическим током образовались два газообразных вещества: водород и кислород (рис. 23), объёмные отношения которых можно выразить следующим образом:
Разложение воды электрическим током (рис. 22). В специальном приборе пропустим через воду электрический ток. Под его действием молекулы воды разрушаются. Продукты протекающей химической реакции — два бесцветных газообразных вещества собираются в трубках прибора. Трубки прибора градуированы, и это позволяет определить, что объёмы газов относятся как 2:1. Если поднести тлеющую лучинку к трубке, содержащей меньший объём газа, и открыть кран, лучинка ярко вспыхнет: один из неизвестных газов оказывается кислородом. При проверке другого газа горящей лучинкой раздаётся негромкий хлопок. Так сгорает водород. Следовательно, при разложении воды электрическим током образовались два газообразных вещества: водород и кислород (рис. 23), объёмные отношения которых можно выразить следующим образом:

 1. Дайте формулировку закона постоянства состава. Каково его практическое значение?
1. Дайте формулировку закона постоянства состава. Каково его практическое значение?
 2. Опишите качественный и количественный состав следующих веществ: H2S — сероводород; HNO3 — азотная кислота; MgSO4 — сульфат магния; Аl2О3 — оксид алюминия; Н3РO4 — ортофосфорная кислота.
2. Опишите качественный и количественный состав следующих веществ: H2S — сероводород; HNO3 — азотная кислота; MgSO4 — сульфат магния; Аl2О3 — оксид алюминия; Н3РO4 — ортофосфорная кислота.