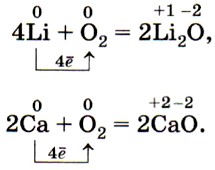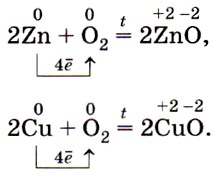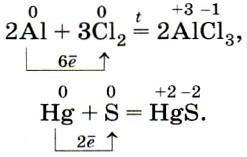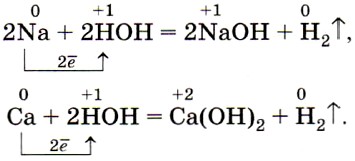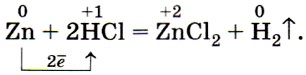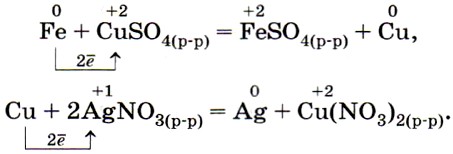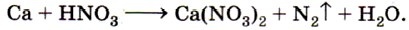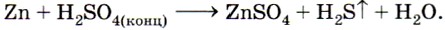|
|
|
|
|
Глава 2. Металлы § 11. Химические свойства металловВ химических реакциях металлы проявляют только восстановительные свойства, т. е. их атомы отдают электроны, образуя в результате положительные ионы. Окислителями при этом могут выступать неметаллы (кислород, галогены, сера и др.), катионы водорода Н+ и катионы других металлов. С кислородом воздуха легко взаимодействуют щелочные и щёлочноземельные металлы (поэтому их хранят под керосином):
Железо, цинк, медь и другие менее активные металлы энергично окисляются кислородом только при нагревании:
Золото и платиновые металлы не окисляются кислородом воздуха ни при каких условиях. Как вы уже знаете, металлы образуют с неметаллами бинарные соединения — оксиды, хлориды, сульфиды, фосфиды ит. д., например:
Щелочные и щёлочноземельные металлы легко реагируют с водой, восстанавливая катионы водорода до свободного водорода, и образуют при этом растворимые основания — щёлочи:
Менее активные металлы, например железо, взаимодействуют с водой только в раскалённом виде:
При этом, как и при горении железа, получается оксид состава Fe3O4 (железная окалина), который представляет собой смесь двух оксидов FeO • Fe2O3. По восстановительной способности, как вы уже знаете, металлы располагают в ряд, который называют электрохимическим рядом напряжений: К, Са, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au. В этот ряд помещён и водород, который, как и металлы, способен отдавать электроны, образуя при этом положительно заряженные ионы Н+. Как вы, очевидно, помните из курса химии 9 класса, из положения металлов в ряду напряжений вытекают два правила, характеризующие химические свойства металлов. Повторим их. 1. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот (рис. 35), а стоящие правее, как правило, не вытесняют водород из растворов кислот:
Известно, что золото, ртуть и серебро не реагируют с соляной кислотой. Напомним, что это правило имеет ряд поправок:
2. Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее, например (рис. 36):
Это правило также имеет поправки, аналогичные таковым к первому правилу, а именно — правило соблюдается при условии образования растворимой соли; правило не распространяется на щелочные металлы.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Определите число электронов, которое отдают три атома железа молекуле воды в реакции образования железной окалины. 2. Вычислите объём воздуха (н. у.), который потребуется для сжигания 36 г магния. (Напоминаем, что объёмная доля кислорода в воздухе равна 0,21.) 3. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 120 мг кальция, если выход газа составляет 80% от теоретически возможного. 4. Почему щелочные и щёлочноземельные металлы хранят под керосином? Почему литий, в отличие от натрия и калия, хранят в вазелине? 5. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которого:
Какой ион проявляет в этой реакции окислительные свойства? 6. Можно ли получить водород при взаимодействии свинца с раствором серной кислоты? 7. Методом электронного баланса определите коэффициенты в уравнении реакции, схема которой:
Какое вещество проявляет в этой реакции восстановительные свойства?
|
|
|