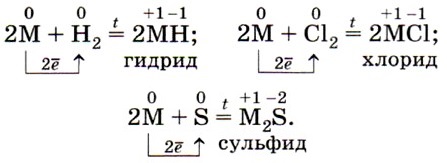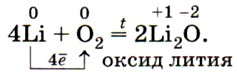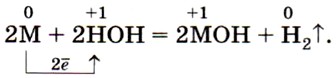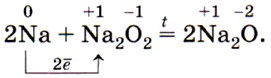|
|
|
|
|
Глава 2. Металлы § 14. Щелочные металлыСтроение и свойства атомов. Щелочные металлы — это элементы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Франций — редкий радиоактивный элемент.
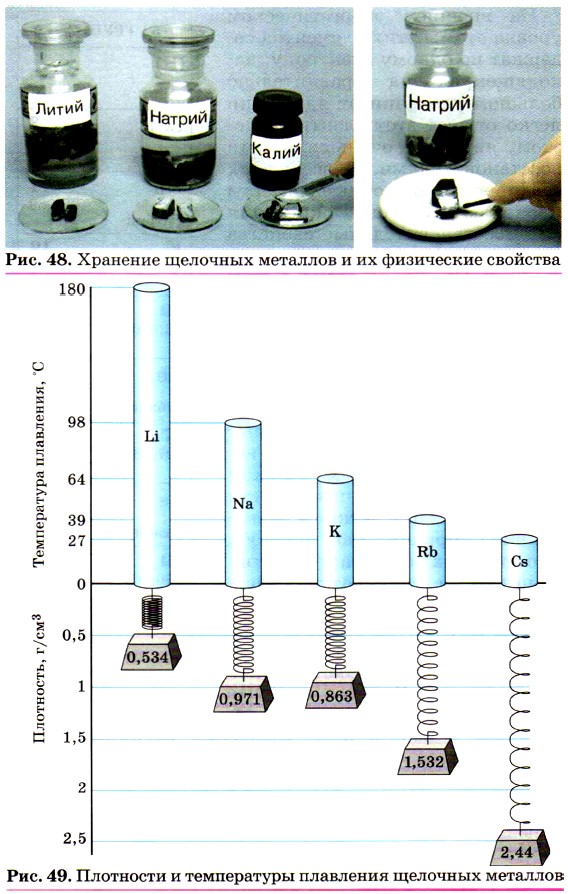
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Cs, что связано с увеличением радиусов их атомов. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко. Щелочные металлы — простые вещества. Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности (рис. 48). Все они лёгкие и легкоплавкие, причём, как правило, плотность их возрастает от лития к цезию, а температура плавления, наоборот, уменьшается (рис. 49). Щелочные металлы активно взаимодействуют почти со всеми неметаллами. Используя общее обозначение для металлов М, запишем в общем виде уравнения реакций щелочных металлов с неметаллами — водородом, хлором и серой:
При взаимодействии с кислородом натрий образует не оксид, а пероксид:
И только литий образует оксид при взаимодействии с кислородом:
Как вы уже знаете, все щелочные металлы активно взаимодействуют с водой, образуя щёлочи и восстанавливая воду до водорода (рис. 50 и 51):
Скорость взаимодействия щелочного металла с водой будет увеличиваться от лития к цезию (почему?). Соединения щелочных металлов. В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах. Рассмотрим основные соединения щелочных металлов на примере соединений натрия и калия — наиболее важных представителей этой группы элементов. Оксиды М2O — твёрдые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с водой, кислотами и кислотными оксидами (запишите уравнения соответствующих реакций). Оксиды натрия Na2O и калия К2O получают, прокаливая пероксиды с соответствующими металлами, например:
Гидроксиды МОН — твёрдые белые вещества. Очень гигроскопичны. Хорошо растворяются в воде с выделением большого количества теплоты. Их относят к щелочам, они проявляют ярко выраженные свойства сильных растворимых оснований: взаимодействуют с кислотами, кислотными оксидами, солями, амфотерными оксидами и гидроксидами (запишите уравнения соответствующих реакций в молекулярной и ионной формах). Гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов или их оксидов с водой (запишите уравнения соответствующих реакций). Гидроксид натрия NaOH в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали. Оба гидроксида — NaOH и КОН — разъедают ткани и бумагу, поэтому их называют также едкими щелочами. Едкий натр применяют в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон. Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла. Соли щелочных металлов — твёрдые кристаллические вещества ионного строения. Почти все соли натрия и калия растворимы в воде. Наиболее важные их соли — карбонаты, сульфаты и хлориды. Na2CO3 — карбонат натрия, образует кристаллогидрат Na2CO3 • 10Н2O, известный под названием кристаллическая сода, которую применяют в производстве стекла, бумаги, мыла. Это средняя соль. Вам в быту более известна кислая соль — гидрокарбонат натрия NaHCO3 (пищевая сода), которую применяют в пищевой промышленности, в медицине. К2СO3 — карбонат калия, техническое название — поташ, используют в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения. Na2SO4 • 10H2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяют для производства соды и стекла и в качестве слабительного средства. NaCl — хлорид натрия, или поваренная соль, хорошо известен вам из курса 9 класса. Хлорид натрия является важнейшим сырьём в химической промышленности, широко применяется в быту (рис. 52). Ионы натрия и калия очень важны для живых организмов: Na+ — главный внеклеточный ион, содержится в крови и лимфе, а К+ — основной внутриклеточный ион. Они выполняют разные функции в организме, но предпочитают «работать» вместе. Соотношение концентраций этих ионов регулирует давление крови в живом организме; обеспечивает перемещение растворов солей из корней в листья растений. Калий поддерживает работу сердечной мышцы, поэтому нехватка калия в организме отрицательно сказывается на здоровье человека. Калий необходим растениям, при его недостатке снижается интенсивность фотосинтеза.
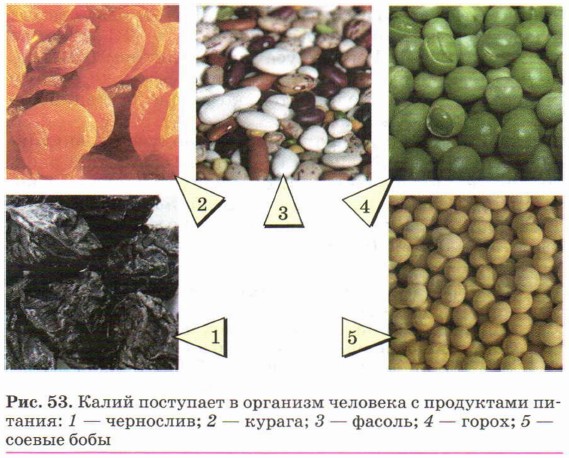
Взрослый человек должен в сутки потреблять с пищей 3,5 г калия. С помощью соединений калия можно устранять отёки. В этом случае нужно увеличить потребление калия до 5 г в сутки. Больше всего калия содержат курага, соя, фасоль, зелёный горошек, чернослив, изюм и некоторые другие продукты (рис. 53). Соли калия широко используют в сельском хозяйстве в качестве калийных удобрений.
Соли натрия, как и сам натрий, окрашивают пламя в жёлтый цвет, а калий и его соли — в розово-фиолетовый. Проведём лабораторный опыт.
Открытие щелочных металлов. Литий был открыт шведским химиком А. Арфведсоном в 1817 г. и по предложению Й. Берцелиуса назван литием (от греч. литое — камень), так как, в отличие от калия, который до тех пор находили только в золе растений, он был обнаружен в камне. Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей. Й. Берцелиус предложил назвать элемент № 11 натрием (от араб, натрун — сода), а элемент № 19 по предложению У. Гилберта получил название «калий» (от араб, алкали — щёлочь).
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
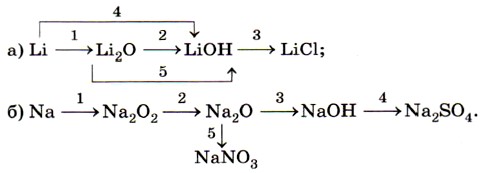
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
2. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход водорода составляет 95% от теоретически возможного. 3. Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991).
В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый лёгкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень лёгким и всплывал в керосине. Но всё же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании. И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод? Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны Кислороду отдаёшь? Не лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете. Я рад, что в моём оксиде Кислород имеет свою обычную степень окисления —2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушёл восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава М2O дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия — нагреют пероксид (Na2O2) с таким же металлом-«жадиной» (Na)». Какие химические понятия использовала в художественной форме Наташа? 4. Напишите сочинение о щелочных металлах, положив в основу сюжета превращения этих металлов или какой- либо один химический процесс. 5. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
|
|
|