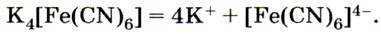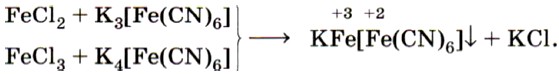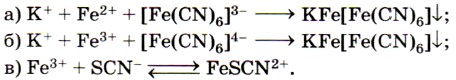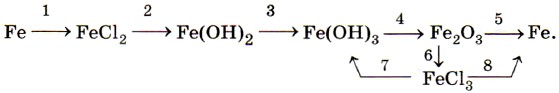|
|
|
|
|
Глава 2. Металлы § 17. Железо
Строение и свойства атомов. Железо Fe — элемент побочной подгруппы VIII группы (УIIIБ группы) 4-го периода Периодической системы Д. И. Менделеева. Строение электронной оболочки атомов железа несколько отличается от строения электронных оболочек атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах железа таково:
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но часто и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3. Железо — простое вещество. Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куётся, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твёрдость методами термического и механического воздействия, например с помощью закалки и прокатки. Различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, оно содержит 0,02—0,04% углерода, а кислорода, серы, азота и фосфора — ещё меньше.
Химически чистое железо содержит менее 0,01% примесей. Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии. Очевидно, знаменитая Делийская колонна сделана из чистого железа (рис. 68). Первые образцы железа, попавшего в руки человека, по-видимому, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа. Алхимики обозначали железо в виде копья и щита — характерных атрибутов бога войны Марса. В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы и кончая космическими аппаратами, не может быть изготовлено без применения железа. Переходя к описанию химических свойств железа, повторим, что оно может проявлять степени окисления +2 и +3, соответственно железо даёт два ряда соединений. Число электронов, которое атом железа отдаёт при химических взаимодействиях, зависит от окислительной способности реагирующих с ним веществ. Например, с галогенами (кроме иода) железо образует галогениды, в которых оно имеет степень окисления +3:
а с серой — сульфид железа (II):
При высокой температуре (700—900 °С) железо взаимодействует с парами воды:
В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него, из водных растворов их солей, например:
В разбавленных соляной и серной кислотах железо растворяется, окисляясь ионами водорода, при этом образуются соли железа (II) и водород:
Растворяется железо и в разбавленной азотной кислоте, при этом образуются нитрат железа (III), вода и продукт восстановления азотной кислоты — азот N2, оксид азота (II) NO или аммиак NH3 (нитрат аммония NH4NO3) в зависимости от концентрации кислоты. Концентрированные серная и азотная кислоты пассивируют железо, образуя на поверхности металла плотную, прочную оксидную плёнку. Соединения железа. По распространённости в земной коре железо занимает четвёртое место среди всех элементов (после кислорода, кремния и алюминия). В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) 2Fe2O3 • ЗН2O. Все они используются в чёрной металлургии для производства чугуна и стали. Ещё одно природное соединение железа — железный, или серный, колчедан (пирит) FeS2 — не служит железной рудой для получения металла, но применяется для производства серной кислоты. Как уже было сказано выше, для железа характерны два ряда соединений: соединения железа (II) и железа (III). Оксид железа (II) FeO и соответствующий ему гидроксид железа (II) Fe(OH)2 получают косвенно, в частности по следующей цепочке превращений:
Оксид и гидроксид железа (II) имеют ярко выраженные основные свойства. Катионы железа (II) Fe2+ легко окисляются кислородом воздуха или другими окислителями, например пероксидом водорода, до катионов железа (III) Fe3+. Поэтому белый осадок гидроксида железа (II) Fe(OH)2 на воздухе сначала приобретает зелёную окраску, а затем становится бурым, постепенно превращаясь в гидроксид железа (III) Fe(OH)3:
Оксид железа (III) Fe2O3 и соответствующий ему гидроксид железа (III) Fe(OH)3 также получают косвенно, например по цепочке:
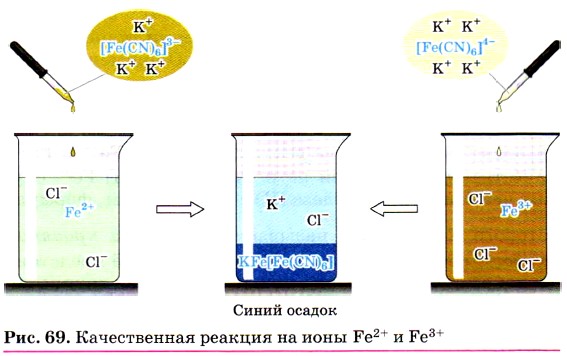
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды. Кристаллогидрат сульфата железа (II) FeSO4 • 7Н2O, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины и в других целях. Хлорид железа (III) FeCl3 используют при очистке воды, в качестве протравы при крашении тканей. Сульфат железа (III) Fe2(SO4)3 • 9Н2O применяют при очистке воды, в качестве растворителя в гидрометаллургии и в других целях. Для распознавания соединений железа (II) и (III) проводят качественные реакции на ионы Fe2+ и Fe3+. Качественной реакцией на ионы железа (II) Fe2+ служит реакция солей железа (II) с соединением, формула которого
Реактивом на ионы железа (III) Fe3+ является другое комплексное соединение — жёлтая кровяная соль —
Если к растворам, содержащим ионы Fe2+ или Fe3+, прилить соответственно растворы красной кровяной соли (реактив на Fe2+) и жёлтой кровяной соли (реактив на Fe3+), то в обоих случаях выпадет одинаковый синий осадок (рис. 69):
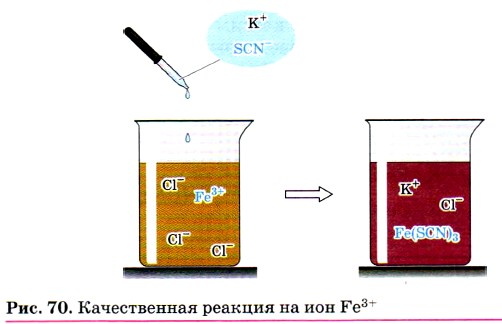
Для обнаружения ионов Fe3+ также используют взаимодействие солей железа (III) с роданидом калия KSCN или роданидом аммония NH4SCN.
При этом образуется ярко окрашенный ион FeSCN2+, а раствор приобретает интенсивно-красный цвет (рис. 70):
Роль химического элемента железа в жизнедеятельности живых организмов очень велика. Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и тканям.
Соединения железа издавна применяют для лечения малокровия, при истощении, упадке сил. Для человека и животных источником железа служит пища. В зелёных овощах, таких как шпинат, салат, капуста, много железа. Розовая черешня содержит наполовину меньше железа, чем чёрная. Светло-зелёный капустный лист в шесть раз беднее железом, чем зелёный. В говядине железа больше, чем в телятине.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Напишите уравнения реакций, иллюстрирующих генетические ряды соединений Fe2+ и Fe3+. Первые реакции каждого ряда охарактеризуйте с позиций окисления-восстановления, а реакции с участием электролитов запишите также в ионном виде. 2. Напишите по два молекулярных уравнения, соответствующих следующим сокращённым ионным уравнениям:
3. Используя дополнительную литературу (словари русского языка, химические словари и др.), подготовьте рассказ о происхождении названий реактивов и продуктов качественных реакций на Fe2+ и Fe3+. 4. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
Рассмотрите два превращения (по выбору) с позиций окисления-восстановления. Реакции с участием электролитов напишите в молекулярной и ионных формах. 5. Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых продуктом восстановления кислоты будет соответственно N2, NO, NH4NO3. Для расстановки коэффициентов в уравнениях химических реакций используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях. 6. Вычислите объём оксида углерода (II) (н. у.), который потребуется для восстановления железа из 2,32 т магнитного железняка, содержащего 5% пустой породы. Вычислите количество вещества железа, которое при этом получится, если выход его составляет 80% от теоретически возможного. 7. Используя свои знания по химии железа, напишите сочинение на тему «Художественный образ вещества или химического процесса».
|
|
|




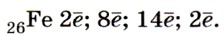

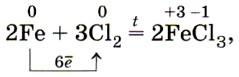
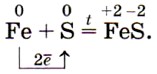
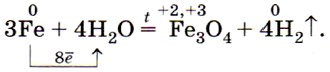
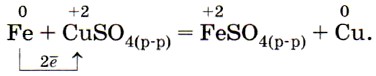
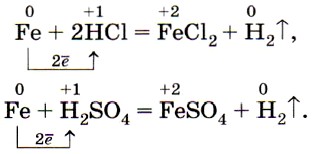

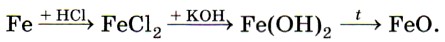
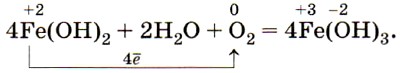
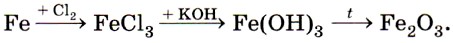

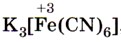 , называемым красной кровяной солью. С соединениями такого типа вам ещё предстоит познакомиться в старшей школе. Это особая группа солей, которые, как вы знаете, называют комплексными. Пока же вам нужно усвоить, как диссоциируют такие соли:
, называемым красной кровяной солью. С соединениями такого типа вам ещё предстоит познакомиться в старшей школе. Это особая группа солей, которые, как вы знаете, называют комплексными. Пока же вам нужно усвоить, как диссоциируют такие соли:
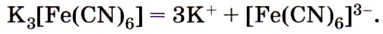
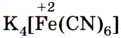 , которая в растворе диссоциирует аналогично:
, которая в растворе диссоциирует аналогично: