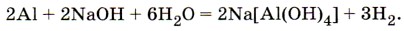|
|
|
|
|
Глава 3. Неметаллы § 19. Водород
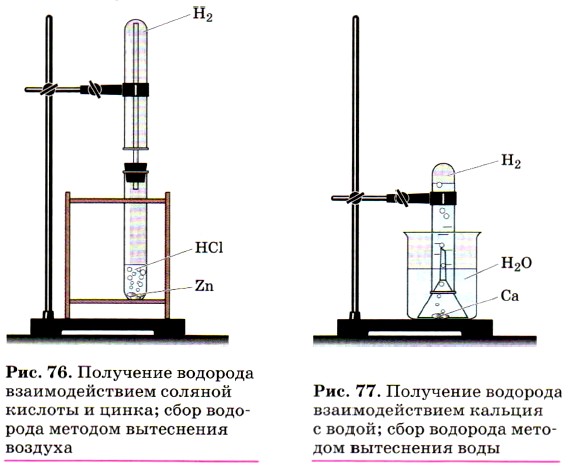
Строение и свойства атомов. Вы, очевидно, обратили внимание на то, что каждому элементу в Периодической системе Д. И. Менделеева отводится одно, строго определённое место. Совсем другое дело химический элемент водород. Это единственный элемент, для которого химики отводят в Периодической системе Д. И. Менделеева два места — да каких! Его записывают в две резко противоположные по свойствам группы химических элементов: в главную подгруппу I группы — подгруппу щелочных металлов, а также в главную подгруппу VII группы — подгруппу галогенов. Почему? Подобно атомам щелочных металлов, атом водорода содержит на внешнем и единственном энергетическом уровне один электрон, поэтому легко отдаёт его и проявляет восстановительные свойства, получая при этом степень окисления +1. Эти особенности сближают водород с щелочными металлами. Но, подобно атомам галогенов (химических элементов главной подгруппы VII группы Периодической системы Д. И. Менделеева), атому водорода до завершения внешнего энергетического уровня не хватает одного электрона (атом благородного газа 2-го периода, гелия, содержит на первом и единственном завершённом уровне два электрона), поэтому водород способен проявлять окислительные свойства в реакциях с металлами, забирая у них этот электрон и получая в результате степень окисления -1. Молекулы водорода, как и молекулы галогенов, двухатомны и образованы за счёт неполярной ковалентной химической связи. При обычных условиях водород — это газ, так же как и фтор, и хлор. Водород — простое вещество. Молекула водорода состоит из двух атомов и образована ковалентной неполярной химической связью. Это самый лёгкий из газов. Он более чем в 14 раз легче воздуха, поэтому водород собирают в перевёрнутый вверх дном сосуд (рис. 76). Водород почти нерастворим в воде, поэтому его можно собирать и способом вытеснения воды (рис. 77). Как распознают водород, вы уже знаете: по характерному глухому хлопку-взрыву при поднесении горящей спички к сосуду (пробирке) с чистым водородом и по особому («лающему») взрыву при поднесении горящей спички к сосуду со смесью водорода с воздухом или с кислородом (2V (Н2) : 1V (O2)), которую называют «гремучим газом». Химические свойства водорода определяются его способностью как к восстановлению, так и к окислению.
Восстановительные свойства водорода. Реакцию горения водорода, уравнение которой применяют как при сварке и резке металлов из-за высокой температуры, сопровождающей эту реакцию. Водород также используют в качестве топлива в ракетных двигателях.
Реакции водорода с неметаллами используют для получения важнейших химических продуктов, например аммиака и хлороводорода:
Водород является восстановителем не только по отношению к простым веществам, но также и по отношению к сложным. Так, его можно использовать для восстановления металлов из их оксидов (рис. 78), например:
Водород взаимодействует с оксидом углерода (II), образуя важнейшее органическое соединение — метиловый спирт, который служит сырьём при получении некоторых пластмасс. С помощью водорода жидкие жиры масла превращают в твёрдые — маргарин. С этими реакциями водорода вы познакомитесь при изучении органической химии. Окислительные свойства водорода проявляются при его взаимодействии с металлами, в результате которого образуются твёрдые солеподобные соединения — гидриды:
Важнейшие области применения водорода, основанные на его свойствах, приведены на рисунке 79. Водород в природе. Получение водорода. В космосе водород является самым распространённым элементом — из каждых 10 атомов Вселенной на долю водорода приходится 8. Наше Солнце более чем наполовину состоит из водорода. На этой звезде, как и на многих других, из ядер атомов водорода образуются ядра атомов гелия и других более тяжёлых химических элементов. Этот процесс сопровождается выделением огромного количества энергии, за счёт которой и существует жизнь на нашей планете.
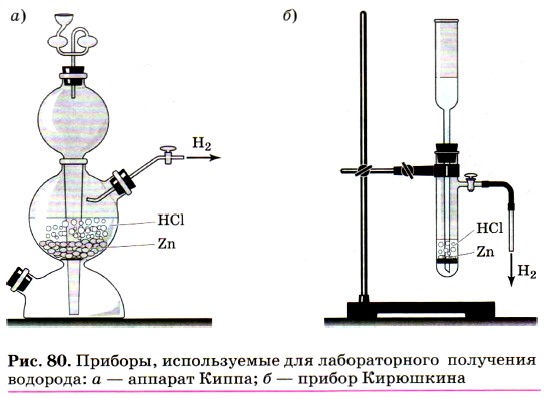
На Земле водород содержится в виде соединений, важнейшим из которых является вода, образующая такую геологическую оболочку планеты, как гидросфера. Этот элемент наряду с углеродом образует все органические вещества, в том числе и жизненно важные (белки, жиры, углеводы), и богатые энергией (природный газ, нефть, каменный уголь). Водород в лаборатории можно получить взаимодействием соляной или разбавленной серной кислот с металлами, стоящими в ряду напряжений до (Н2), в первую очередь цинка:
С этой целью в лабораторных условиях применяют специальные приборы: аппарат Киппа (рис. 80, а) или его маленький аналог — прибор Кирюшкина (рис. 80, б).
В промышленности водород получают конверсией (превращением) водяных паров с углем или метаном:
Открытие водорода. Ещё в XVI в. было замечено, что при действии кислот на металлы выделяется газ, который средневековые химики называли «горючим воздухом». Первооткрывателем водорода считают английского физика и химика Г. Кавендиша. В 1766 г. он собрал чистый водород, получив его действием серной и соляной кислот на цинк, железо и олово. Однако вывод о том, что водород представляет собой вещество, а не «горючий воздух», был сделан только в 1784г. французским химиком А. Лавуазье, который и дал этому элементу название «водород» — рождающий воду.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
Водород образует три изотопа: В лаборатории водород можно получить, как вы знаете, взаимодействием щелочного или щёлочноземельного металла с водой, а также по реакции:
В каком случае объём водорода наибольший, если для получения водорода используются одинаковые количества веществ металлов? 3. Вычислите объём водорода (н. у.), который потребуется для восстановления 928 кг оксида вольфрама (VI), содержащего 25% примесей. Вычислите количество вещества металла, которое получится при этом. 4. Запишите уравнения реакций для следующих переходов:
5. В стеклянном толстостенном сосуде (эвдиометре) взорвали смесь 4 мл водорода и 3 мл кислорода. Найдите массу продукта реакции и объём непрореагировавшего газа.
|
|
|




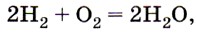

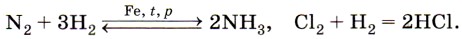
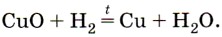
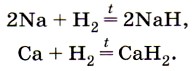

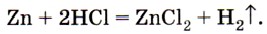

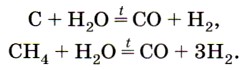


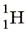 — протий,
— протий, 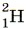 или
или 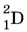 — дейтерий и
— дейтерий и 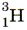 или
или 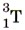 — тритий. Запишите все возможные формулы воды, которые образуют эти изотопы водорода с одним из изотопов кислорода, например
— тритий. Запишите все возможные формулы воды, которые образуют эти изотопы водорода с одним из изотопов кислорода, например 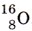 . В какой из молекул содержание водорода наименьшее? Рассчитайте его.
. В какой из молекул содержание водорода наименьшее? Рассчитайте его.