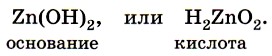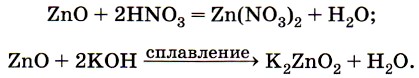|
|
|
|
|
Глава 1. Общая характеристика химических элементов и химических реакций § 2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксидыСущественным отличительным признаком элементов является кислотный или основный характер соответствующих им оксидов и гидроксидов. Вы уже знаете, что металлы в степени окисления +1 и +2 образуют, как правило, основные оксиды, а в качестве гидроксидов — основания. Металлы с большим значением степени окисления (+6, +7) и неметаллы образуют кислотные оксиды, которым соответствуют кислородсодержащие кислоты. Проведём небольшой лабораторный опыт. Получим гидроксид цинка и исследуем его химические свойства.
В чём причина такого необычного поведения Zn(OH)2 как нерастворимого основания? Опыт показывает, что гидроксид цинка проявляет свойства оснований, взаимодействуя с кислотой, но он также ведёт себя и как нерастворимая кислота, взаимодействуя с щёлочью.
Таким образом, гидроксиду цинка присущи амфотерные свойства: он может реагировать с кислотами как основание и с щелочами как кислота. Соответственно формулу этого соединения можно представить двояко:
Тогда уравнения реакций гидроксида цинка с кислотой и с щёлочью можно записать так:
В обоих случаях образуется растворимая соль. Аналогично гидроксиду цинка и соответствующий ему оксид цинка проявляет амфотерные свойства — образует соли при взаимодействии как с кислотами, так и с основаниями, например:
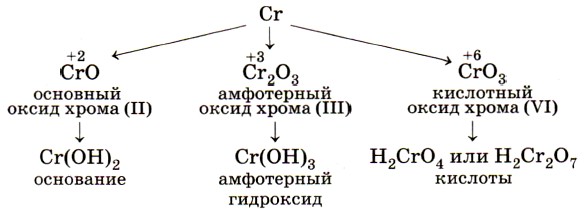
В первой реакции оксид цинка ведёт себя как основный оксид, а во второй реакции выступает в роли кислотного оксида — образует соль, в которой цинк входит в состав кислотного остатка. Амфотерными являются оксиды и гидроксиды многих элементов, например бериллия, алюминия, хрома (III). Если элемент-металл проявляет несколько степеней окисления, то его оксид и гидроксид с низшей степенью окисления будут проявлять, как правило, основные свойства, с высшей — кислотные, а с промежуточной — амфотерные. Например, для хрома:
Амфотерные оксиды и гидроксиды образуют чаще всего те элементы, которые составляют побочные подгруппы Периодической системы Д. И. Менделеева. Эти элементы называют переходными элементами или переходными металлами.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Почему для получения амфотерного гидроксида из раствора соли переходного элемента раствор щёлочи к ней приливают по каплям? 2. Запишите уравнения реакций для следующих превращений:
Первую реакцию рассмотрите с позиций окисления-восстановления. 3. Приведите по два молекулярных уравнения реакций, соответствующих сокращённым ионным уравнениям: а) Ве(ОН)2 + 2Н+→ Ве2+ + 2Н2O;
4. Докажите, что амфотерность подтверждает относительный характер деления элементов на металлы и неметаллы.
|
|
|