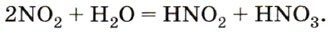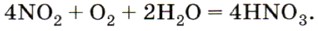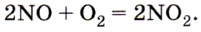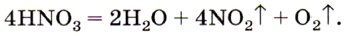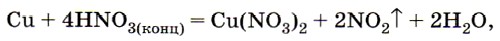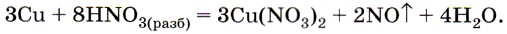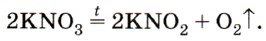|
|
|
|
|
Глава 3. Неметаллы § 31. Кислородные соединения азотаОксиды. Азот образует пять оксидов со степенями окисления +1, +2, +3, +4, +5. Оксиды N2O и NO несолеобразующие (что это означает?), а остальные оксиды — кислотные:
Если его растворить в воде в присутствии избытка кислорода, получается только азотная кислота:
Оксид азота (IV) NO2 — бурый, очень ядовитый газ. Он легко получается при окислении кислородом воздуха бесцветного несолеобразующего оксида азота (II):
Азотная кислота HNO3. Это бесцветная жидкость, которая «дымится» на воздухе. При хранении на свету концентрированная азотная кислота желтеет, так как частично разлагается с образованием бурого газа NO2:
Азотная кислота проявляет все типичные свойства сильных кислот: взаимодействует с оксидами и гидроксидами металлов, с солями (составьте соответствующие уравнения реакций).
С металлами азотная кислота ведёт себя по-особому — ни один из металлов не вытесняет из азотной кислоты водород, независимо от её концентрации (для серной кислоты такое поведение характерно только в её концентрированном состоянии). Это объясняется тем, что HNO3 является сильным окислителем, в ней азот имеет максимальную степень окисления +5. Именно он и будет восстанавливаться при взаимодействии с металлами. Продукт восстановления зависит от положения металла в ряду напряжений, от концентрации кислоты и условий проведения реакции. Например, при взаимодействии с медью концентрированная азотная кислота восстанавливается до оксида азота (IV):
а разбавленная — до оксида азота (II):
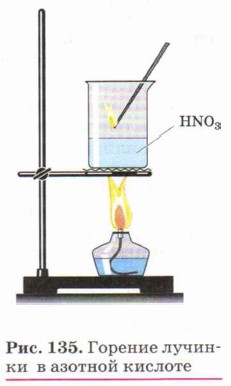
Железо и алюминий при действии концентрированной HNO3 покрываются прочной оксидной плёнкой, предохраняющей металл от дальнейшего окисления, т. е. кислота пассивирует металлы. Поэтому азотную кислоту, как и серную, можно перевозить в стальных и алюминиевых цистернах. Азотная кислота окисляет многие органические вещества, обесцвечивает красители. При этом обычно выделяется много теплоты и вещество воспламеняется. Так, если к азотной кислоте прилить каплю скипидара, то происходит яркая вспышка, а тлеющая лучинка в азотной кислоте загорается (рис. 135). Азотную кислоту широко применяют в химической промышленности для производства азотных удобрений, пластмасс, искусственных волокон, органических красителей и лаков, лекарственных и взрывчатых веществ (рис. 136). Соли азотной кислоты — нитраты получают при действии кислоты на металлы, их оксиды и гидроксиды. Нитраты натрия, калия, кальция и аммония называют селитрами: NaNO3 — натриевая селитра, KNO3 — калийная селитра, Ca(NO3)2 — кальциевая селитра, NH4NO3 — аммиачная селитра. Селитры применяют в качестве азотных удобрений.
Калийную селитру используют также при изготовлении чёрного пороха, а из аммиачной селитры, как вы уже знаете, готовят взрывчатое вещество аммонал. Нитрат серебра, или ляпис, AgNO3 применяют в медицине как прижигающее средство. Почти все нитраты хорошо растворимы в воде. При нагревании они разлагаются с выделением кислорода, например:
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Почему азотная кислота не образует кислых солей? 2. Напишите молекулярные и ионные уравнения реакций азотной кислоты с гидроксидом меди (II), оксидом железа (III) и карбонатом натрия. 3. Большинство солей азотной кислоты растворимы в воде, тем не менее предложите уравнение реакции HNO3 с солью, в результате которой образуется осадок. Напишите ионное уравнение этой реакции. 4. Рассмотрите уравнения реакций разбавленной и концентрированной азотной кислоты с медью с точки зрения процессов окисления-восстановления. 5. Предложите две цепочки превращений, приводящих к получению азотной кислоты, исходя из азота и аммиака. Опишите окислительно-восстановительные реакции, используя метод электронного баланса. 6. Сколько килограммов 68%-й азотной кислоты можно получить из 276 кг (н. у.) оксида азота (IV)? 7. При прокаливании 340 г натриевой селитры получили 33,6 л (н. у.) кислорода. Рассчитайте массовую долю примесей в селитре.
|
|
|



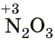 соответствует азотистая кислота
соответствует азотистая кислота 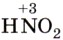 , a
, a 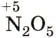 — азотная кислота
— азотная кислота 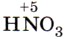 . Оксид азота (IV)
. Оксид азота (IV) 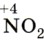 при растворении в воде одновременно образует две кислоты — HNO2 и HNO3:
при растворении в воде одновременно образует две кислоты — HNO2 и HNO3: