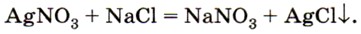|
|
|
|
|
Глава 1. Общая характеристика химических элементов и химических реакций § 5. Химические реакции. Скорость химической реакцииХимические элементы, из которых состоит живая и неживая природа, находятся в постоянном движении, потому что непрерывно изменяются вещества, которые состоят из этих элементов. Химические реакции (от лат. реакция — противодействие, отпор) — это ответное действие веществ на воздействие других веществ и физических факторов (температуры, давления, излучения и др.). Однако такому определению соответствуют также и физические изменения, происходящие с веществами, — кипение, плавление, конденсация и др. Поэтому необходимо уточнить, что химические реакции — это процессы, в результате которых разрушаются старые химические связи и возникают новые и, как следствие, — из исходных веществ образуются новые вещества. Химические реакции непрерывно происходят как внутри нашего организма, так и в окружающем нас мире. Бесчисленное множество реакций принято классифицировать по различным признакам. Давайте вспомним из курса 9 класса признаки, с которыми вы уже знакомы. Для этого обратимся к лабораторному опыту.
Мы подошли к очень важному понятию в химии — «скорость химической реакции». Известно, что одни химические реакции протекают очень быстро, другие — за значительные промежутки времени. При добавлении раствора нитрата серебра к раствору хлорида натрия практически мгновенно выпадает белый творожистый осадок:
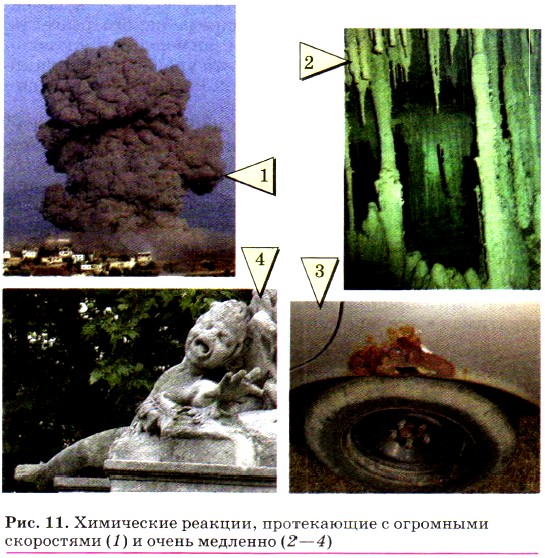
С огромными скоростями протекают реакции, сопровождающиеся взрывом (рис. 11, 1). Наоборот, медленно растут в каменных пещерах сталактиты и сталагмиты (рис. 11, 2), корродируют (ржавеют) стальные изделия (рис. 11, 3), разрушаются под действием кислотных дождей дворцы и статуи (рис. 11, 4).
В свою очередь, под концентрацией понимают отношение количества вещества (как вы знаете, оно измеряется в молях) к объёму, которое оно занимает (в литрах). Отсюда нетрудно вывести единицу измерения скорости химической реакции — 1 моль/(л • с). Изучает скорость химической реакции особый раздел химии, который называют химической кинетикой.
Знание её закономерностей позволяет управлять химической реакцией, заставляя её протекать быстрее или медленнее. От каких же факторов зависит скорость химической реакции? 1. Природа реагирующих веществ. Обратимся к эксперименту.
2. Концентрация реагирующих веществ. И опять обратимся к эксперименту.
Нетрудно сделать вывод: чем выше концентрация реагирующих веществ, тем выше и скорость взаимодействия между ними. Концентрацию газообразных веществ для гомогенных производственных процессов повышают, увеличивая давление. Например, так поступают при производстве серной кислоты, аммиака, этилового спирта. Фактор зависимости скорости химической реакции от концентрации реагирующих веществ учитывается не только на производстве, но и в других областях жизнедеятельности человека, например в медицине. Больным с заболеваниями лёгких, у которых скорость взаимодействия гемоглобина крови с кислородом воздуха низкая, облегчают дыхание с помощью кислородных подушек. 3. Площадь соприкосновения реагирующих веществ. Эксперимент, иллюстрирующий зависимость скорости химической реакции от этого фактора, может быть подтверждён экспериментально.
Для гетерогенных реакций: чем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции. В этом вы могли убедиться на личном опыте. Чтобы разжечь костёр, вы под дрова подкладывали мелкие щепочки, а под них — скомканную бумагу, от которой и загорался весь костёр. Наоборот, тушение пожара водой заключается в уменьшении площади соприкосновения горящих предметов с воздухом. На производстве этот фактор учитывают специально, используют так называемый кипящий слой. Твёрдое вещество для повышения скорости реакции измельчают почти до состояния пыли, а затем через него пропускают снизу второе вещество, как правило газообразное. Прохождение его через мелкораздробленное твёрдое вещество создаёт эффект кипения (отсюда и название метода). Кипящий слой используется, например, при производстве серной кислоты и нефтепродуктов.
4. Температура. И опять обратимся к эксперименту.
Нетрудно сделать вывод: чем выше температура, тем больше скорость реакции. Первый лауреат Нобелевской премии голландский химик Я. X. Вант-Гофф сформулировал правило:
На производстве используются, как правило, высокотемпературные химические процессы: при выплавке чугуна и стали, варке стекла и мыла, производстве бумаги и нефтепродуктов и т. д. (рис. 12). Пятый фактор, от которого зависит скорость химической реакции, — катализаторы. С ним вы познакомитесь в следующем параграфе.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Что такое химическая реакция? В чём суть химических процессов? 2. Дайте полную классификационную характеристику следующих химических процессов: а) горению фосфора;
3. На основе личного опыта приведите примеры химических реакций, протекающих с различной скоростью. 4. Что такое скорость химической реакции? От каких факторов она зависит? 5. Приведите примеры влияния различных факторов на биохимические и производственные химические процессы. 6. На основе личного опыта приведите примеры влияния различных факторов на химические реакции, протекающие в повседневной жизни. 7. Почему продукты питания хранят в холодильнике? 8. Химическую реакцию начали проводить при температуре 100 °С, затем подняли до 150 °С. Температурный коэффициент этой реакции равен 2. Во сколько раз возрастёт скорость химической реакции?
|
|
|