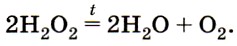|
|
|
|
|
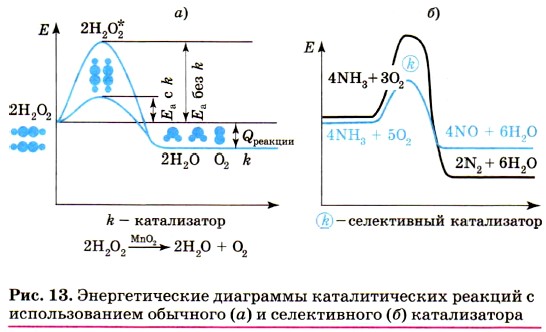
Глава 1. Общая характеристика химических элементов и химических реакций § 6. Катализаторы и катализПочему катализаторы увеличивают скорость химической реакции? Оказывается, они действуют в полном соответствии с народной мудростью: «Умный в гору не пойдёт, умный гору обойдёт». Для того чтобы вещества начали взаимодействовать, их частицам (молекулам, атомам, ионам) нужно сообщить определённую энергию, называемую энергией активации (рис. 13, а). Катализаторы понижают эту энергию, соединяясь с одним из реагирующих веществ и проводя его вдоль «энергетической горы» на встречу с другим веществом с меньшими затратами энергии. Поэтому в присутствии катализатора химические реакции протекают не только быстрее, но и при более низкой температуре, что удешевляет производственные процессы. И не только. Использование катализаторов может привести к тому, что одни и те же вещества будут реагировать по-разному, т. е. с образованием разных продуктов (рис. 13, б).
Например, аммиак окисляется кислородом до азота и воды, а в присутствии катализатора — до оксида азота (II) и воды (запишите уравнения реакции и рассмотрите процессы окисления и восстановления).
Процесс изменения скорости химической реакции или пути, по которому она протекает, называется катализом. Как и реакции, различают гомогенный и гетерогенный виды катализа. В случае использования ферментов катализ называют ферментативным. Этот вид катализа известен человеку с глубокой древности. Благодаря ферментативному расщеплению органических веществ человек научился печь хлеб, варить пиво, изготавливать вино и сыр (рис. 14).
Наиболее известны в быту ферменты, входящие в состав стиральных порошков. Именно они позволяют избавлять бельё при стирке от пятен и неприятного запаха. Познакомимся ближе с катализаторами с помощью химического эксперимента. Пероксид водорода (в обиходе его часто называют перекисью водорода) — необходимый в любой домашней аптечке препарат (рис. 15). На упаковке с этим препаратом обязательно указывается срок годности, так как при хранении он разлагается:
Однако при обычных условиях этот процесс протекает настолько медленно, что мы не замечаем выделения кислорода, и только открыв склянку, в которой пероксид водорода хранился длительное время, можно заметить, как из неё выделяется немного газа. Как ускорить этот процесс? Проведём лабораторный опыт.
Катализаторы не только делают экономичнее производственные процессы, но и вносят значительный вклад в охрану окружающей среды. Так, современные легковые автомобили снабжены каталитическим устройством, внутри которого находятся керамические ячеистые носители катализатора (платины и родия).
Проходя через них, вредные вещества (оксиды углерода, азота, несгоревший бензин) превращаются в углекислый газ, азот и воду (рис. 16). Однако для химических реакций важны не только катализаторы, которые ускоряют прохождение реакции, но и вещества, способные их замедлять. Такие вещества называются ингибиторами. Наиболее известны ингибиторы коррозии металлов.
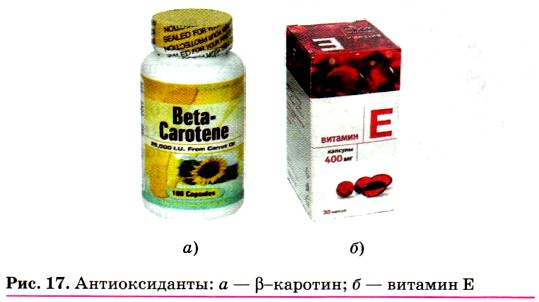
В лексиконе обычного человека нередко встречаются слова, которые заимствованы из химии. Например, антиоксиданты, или антиокислители. Что собой представляют вещества, называемые антиоксидантами? Вы, наверное, замечали, что если долго хранить сливочное масло, то оно изменяет цвет, вкус, приобретает неприятный запах — окисляется на воздухе. Чтобы пищевые продукты не портились, в них добавляют антиоксиданты. Важную роль они играют и в сохранении здоровья человека, ведь в его организме также происходят нежелательные процессы окисления, в результате чего человек болеет, быстрее устаёт и стареет. Организм человека получает антиоксиданты при употреблении в пищу продуктов, содержащих, например, каротин (витамин А) и витамин Е (рис. 17).
Итак, скоростью химической реакции можно управлять с помощью катализаторов и ингибиторов, изменением температуры, концентрации реагирующих веществ, давления (для гомогенных газовых реакций), площади соприкосновения реагирующих веществ (для гетерогенных процессов). И конечно же скорость химических реакций зависит от природы реагирующих веществ.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания. 2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.
1. Что такое катализаторы? Какую роль они играют в химических реакциях? Почему катализаторы ускоряют течение химических реакций? 2. Какую роль в истории человеческой цивилизации сыграл ферментативный катализ? 3. Подготовьте сообщение о роли катализаторов в современном производстве. 4. Подготовьте сообщение о роли ингибиторов в современном производстве. 5. Подготовьте сообщение о роли антиоксидантов в медицине и пищевой промышленности.
|
|
|