|
|
|
|
|
Глава 2. Растворы. Теория электролитической диссоциации Соли как электролитыВ качестве способов получения солей можно рассматривать следующие реакции: 1) между металлами и неметаллами: 2Na + Cl2=2NaCl 2) между металлами и кислотами: Zn + 2НСl = ZnCl2 + Н2↑ 3) между металлами и растворами солей: Сu + HgCl2 = Hg + СuСl2 4) между оксидами металлов и кислотами: CuO + 2НСl = СuСl2 + Н2O 5) между оксидами металлов и неметаллов:
6) между оксидами неметаллов и щелочами: СО2 + 2NaOH = Na2CO3 + Н2O 7) между кислотами и щелочами: H2SO4 + Ва(ОН)2 = BaSO4↓ + 2Н2O 8) между кислотами и солями: H2SO4 + ВаСl2 = BaSO4↓ + 2НСl 9) между щелочами и солями: 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓ 10) между двумя солями: AgNO3 + NaCl = AgCl↓ + NaNO3 Задание. Какие из реакций, характеризующих способы получения солей, являются реакциями ионного обмена? Составьте их уравнения в молекулярной, полной и сокращенной ионной форме. Основные понятия Соли как сильные электролиты • Классификация солей • Способы получения солей • Химические свойства солей Вопросы и задания
|
|
|



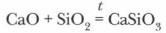
 1. Назовите основные химические свойства кислот, оснований, солей.
1. Назовите основные химические свойства кислот, оснований, солей.
 2. Составьте уравнения реакций, отражающие все возможные способы получения солей: а) сульфат бария; б) сульфид натрия; в) карбонат кальция. Выясните, где и как применяются эти соли.
2. Составьте уравнения реакций, отражающие все возможные способы получения солей: а) сульфат бария; б) сульфид натрия; в) карбонат кальция. Выясните, где и как применяются эти соли.
 4. Технический карбонат калия, или поташ (от немецкого «пот» — горшок и «аш» — зола), — необходимый компонент сырья для производства стекла. В старину (в России — до середины ХIХ в.) его получали из золы древесины. Так, из 1 м3 сожженной древесины вяза получали 0,76 кг поташа, из древесины липы — 0,5 кг поташа. Щелок, полученный обработкой золы водой, выпаривался в горшках до образования кристаллического поташа. Почему такой способ получения экономически и экологически несостоятелен? Какими другими способами он заменен? Опишите эти способы.
4. Технический карбонат калия, или поташ (от немецкого «пот» — горшок и «аш» — зола), — необходимый компонент сырья для производства стекла. В старину (в России — до середины ХIХ в.) его получали из золы древесины. Так, из 1 м3 сожженной древесины вяза получали 0,76 кг поташа, из древесины липы — 0,5 кг поташа. Щелок, полученный обработкой золы водой, выпаривался в горшках до образования кристаллического поташа. Почему такой способ получения экономически и экологически несостоятелен? Какими другими способами он заменен? Опишите эти способы.