|
|
|
|
|
Глава 4. Подгруппа кислорода и ее типичные представители Кислород. ОзонОзон как аллотропное видоизменение кислородаРастворимость его в воде гораздо больше, чем кислорода: в 1 00 объемах воды при 0°С растворяется 49 объемов озона. При низких концентрациях озон не токсичен, а при высоких — ядовит! Предельно допустимое содержание его в воздухе равно ю-5%.
Озон — газ, который, как и многие молекулярные вещества, можно перевести в другие агрегатные состояния — жидкое и твердое. При сильном охлаждении он конденсируется в темно-синюю жидкость, температура кипения которой — 112 °С, а при температуре ниже -192 °С (это температура плавления озона) он превращается в твердое вещество. В твердом состоянии озон почти черный.
В природе озон образуется из кислорода воздуха во время грозовых разрядов, а также при окислении смолы хвойных деревьев.
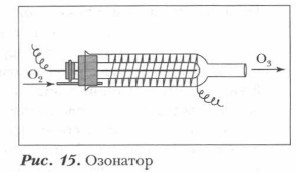
Воздух хвойных лесов считается особенно полезным, в нем всегда содержится некоторое количество озона. Небольшое содержание озона в воздухе благоприятно для организма человека, так как он убивает болезнетворные микроорганизмы. В лаборатории озон обычно получают действием тихого разряда (электрического разряда без искр) на газообразный чистый и высушенный кислород. Для этого используют особый прибор — озонатор, схема которого представлена на рисунке (рис. 1 5).
Основную часть озонатора составляют две вставленные одна в другую стеклянные трубки, между которыми пропускают хорошо высушенный ток кислорода (или воздуха).
Через внутреннюю трубку пропущен металлический стержень, а наружная трубка обмотана металлической спиралью. Стержень и спираль присоединяют к полюсам индукционной катушки высокого напряжения. При включении рубильника катушки тихий разряд происходит в пространстве между стенками внешней и внутренней трубок. Выходит из озонатора кислород или воздух, содержащий несколько процентов озона (в озонированном воздухе ≈ 2-3% озона).
Реакцию получения озона можно выразить уравнением:
Из уравнения видно, что эта реакция — эндотермическая.
Из этого уравнения следуют выводы.
1. Реакция превращения кислорода в озон самопроизвольно протекать не может, для ее осуществления требуется затрата энергии.
2. Обратная реакция — распад озона — самопроизвольно протекающая, так как в ходе ее энергия системы уменьшается.
3. Отсюда следует, что озон — эндотермичное и очень неустойчивое вещество, при высоких концентрациях взрывоопасное, легко превращающееся в кислород.
Химические свойства озона. Наиболее характерным химическим свойством озона является его исключительно высокая окислительная активность. Озон — один из сильнейших окислителей, более сильный, чем кислород. Он взаимодействует со многими веществами, в том числе и с теми, с которыми кислород при обычных условиях не реагирует. В ходе большинства из этих реакций молекула озона теряет один атом кислорода, идущий на окисление веществ, и переходит в молекулярный кислород. Так, при пропускании озонированного воздуха через водный раствор иодида калия выделяется свободный иод.
2KI + Н2O + O3 = I2 + 2КОН + 2O2
Озон окисляет все металлы, кроме золота и платиновых металлов, и большинство неметаллов. Так, металлическое серебро под действием озона чернеет, образуя на поверхности металла оксид серебра (II):
Ag + O3 = AgO + O2
Озон способен переводить низшие оксиды в высшие, а сульфиды металлов в их сульфаты:
PbS + 2O3 = PbSO4 + O2
Озон, в отличие от молекулярного кислорода, на холоде окисляет многие органические вещества. Например, резина под его действием разрушается, а спирт, эфир, смоченная скипидаром, керосином и другими органическими жидкостями вата самовоспламеняются.
Применение озона. Как сильный окислитель озон широко используют на водоочистительных станциях для окончательной очистки воды от болезнетворных микробов, а также для обеззараживания воздуха. Озон используют также в научных лабораториях для установления строения молекул некоторых веществ.
В верхних слоях земной атмосферы (в стратосфере) озон получается из кислорода под воздействием ультрафиолетового излучения Солнца, образуя озоновый слой, защищающий Землю от проникновения губительной для живых организмов ультрафиолетовой радиации. В настоящее время образовавшиеся над Землей «озоновые дыры» представляют серьезную экологическую проблему. Озон, содержащийся в стратосфере, воздействует и на климат, он — важный фактор формирования средней температуры воздуха, а следовательно, и климата. Поэтому любые виды человеческой деятельности, приводящие к уменьшению среднего содержания озона в стратосфере, имеют весьма серьезные последствия для климата, здоровья людей, состояния всей живой природы (более подробно об этом вы узнаете в 10-1 1 классах).
Выводы 1. Кислород — самый распространенный элемент на Земле, элемент VIA-группы неметаллов. 2. Электронная формула атома кислорода — ls22s22p4. 3. Кислород — сильный окислитель, по величине ОЭО он уступает лишь фтору и образует огромное число соединений с атомами других элементов. 4. Кислород взаимодействует с простыми и сложными веществами с образованием различных оксидов, проявляя в них степень окисления -2. 5. Кислород играет чрезвычайно важную роль в биологических системах, участвуя в процессах дыхания и обмена веществ. Его широко используют в металлургии, химической промышленности, в медицине, авиации и др. 6. Аллотропной формой кислорода является озон, являющийся более сильным окислителем, чем кислород. Основные понятия Атом кислорода • Строение молекулы кислорода • Степени окисления кислорода в соединениях • Кислород как окислитель • Озон • Окислительная активность озона • Озонатор Вопросы и задания
|
|
|



 Озон — молекулярное простое вещество, его молекулярная масса равна 48. Поскольку молекулярная масса кислорода равна 32, легко посчитать, что молекула озона состоит из трех атомов кислорода — O3. Она имеет форму равнобедренного треугольника. При обычных условиях озон — газ светло-голубого цвета с характерным запахом, который можно ощутить, гуляя в сосновом бору после грозы. Озон в 1,5 раза тяжелее кислорода.
Озон — молекулярное простое вещество, его молекулярная масса равна 48. Поскольку молекулярная масса кислорода равна 32, легко посчитать, что молекула озона состоит из трех атомов кислорода — O3. Она имеет форму равнобедренного треугольника. При обычных условиях озон — газ светло-голубого цвета с характерным запахом, который можно ощутить, гуляя в сосновом бору после грозы. Озон в 1,5 раза тяжелее кислорода.
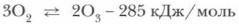
 1. Чем отличается элемент кислород от других элементов VLA-группы?
1. Чем отличается элемент кислород от других элементов VLA-группы?
 3. Почему озон лучше кислорода растворяется в воде? Объясните причину.
3. Почему озон лучше кислорода растворяется в воде? Объясните причину.
 6. В кислороде, полученном при нагревании 20 г перманганата калия, сожгли 1,2 г угля. Какова массовая доля (в %) перманганата калия, который подвергся разложению?
6. В кислороде, полученном при нагревании 20 г перманганата калия, сожгли 1,2 г угля. Какова массовая доля (в %) перманганата калия, который подвергся разложению?
 7. Составьте краткий схематический обзор, отражающий взаимосвязи состава, строения, свойств и применения озона, используя символико-графические формы описания.
7. Составьте краткий схематический обзор, отражающий взаимосвязи состава, строения, свойств и применения озона, используя символико-графические формы описания.