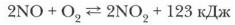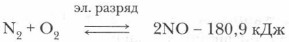|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители § 24. Оксиды азота
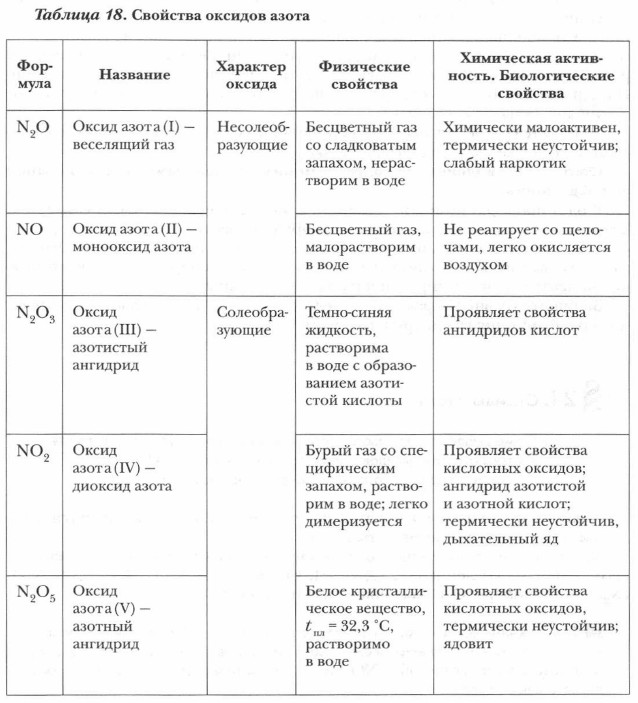
К важнейшим кислородсодержащим соединениям азота относятся оксиды, кислородсодержащие кислоты и их соли. Для азота известны оксиды, отвечающие всем его возможным положительным степеням окисления (+1, +2, +3, +4, +5): N2O, NO, N2O3, NO2, N2O4, N2O5 (N2O4 — это димер NO2). Важнейшие из них NO и NO2. Первые два оксида — N2Oи NO — несолеобразующие оксиды, остальные — солеобразующие кислотные оксиды. Наибольшее практическое значение из них имеют два оксида — оксид азота (II) и оксид азота (IV), которые и будут изучаться. Диоксид азота NO2 часто рассматривают как кислотный оксид, образующий азотистую и азотную кислоты. Некоторые свойства оксидов азота представлены в обобщающей таблице 18.
Оксид азота (II)
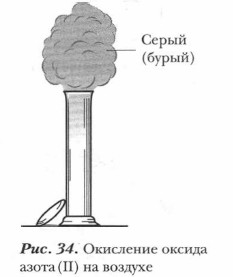
Газообразное вещество без цвета и запаха при нормальных условиях, малорастворимо в воде: при О °С в 1 объеме воды растворяется всего 0,07 объема монооксида азота. При t-151,8 °С сжижается, при t -163,7 °С затвердевает. По химическим свойствам оксид азота (II) относится к несолеобразующим, или безразличным, оксидам, так как он не образует никакой кислоты и не реагирует со щелочами. Но он легко окисляется кислородом воздуха. Стоит только снять с сосуда с оксидом азота (II) закрывающее его стекло, как над сосудом появляется бурое облако оксида азота (IV) с резким запахом (рис. 34). Эта реакция экзотермическая и обратимая. Реакция протекает следующим образом:
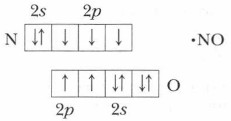
При повышении температуры и понижении давления равновесие смещается влево. Проблема. Какова причина такой высокой реакционной способности этого несолеобразующего оксида? Молекулы, имеющие орбиталь с одним неспаренным электроном, обладают высокой химической активностью.
Оксид азота (II) — единственный из всех оксидов азота, который образуется при непосредственном взаимодействии кислорода с азотом.
|
|
|



 Какие вещества называются оксидами и на какие группы они делятся?
Какие вещества называются оксидами и на какие группы они делятся?
 При обычных условиях азот с кислородом не взаимодействует. Лишь при пропускании через их смесь электрического разряда или непосредственно в грозу может образоваться оксид азота (II) — NO. Остальные оксиды азота получаются из азотной кислоты или ее солей.
При обычных условиях азот с кислородом не взаимодействует. Лишь при пропускании через их смесь электрического разряда или непосредственно в грозу может образоваться оксид азота (II) — NO. Остальные оксиды азота получаются из азотной кислоты или ее солей.