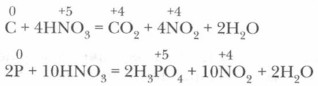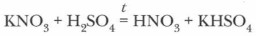|
|
|
|
|
Глава 5. Подгруппа азота и ее типичные представители § 25. Азотная кислота и ее соли
Состав и строение. Молекула азотной кислоты HNO3 состоит из атомов трех элементов, соединенных между собой ковалентными связями. Это молекулярное вещество, содержащее предельно окисленный атом азота в высшей степени окисления +5. Однако валентность азота в HNO3 равна четырем. Проблема. Как объяснить, что валентность азота и его степень окисления в молекуле HNO3 не совпадают?
Степень же окисления азота равна +5, поскольку все пять электронов внешнего электронного слоя атома азота оттянуты от него к более электроотрицательным атомам кислорода. Физические свойства. Чистая азотная кислота — бесцветная жидкость, дымящаяся на воздухе, с едким запахом. Концентрированная азотная кислота обычно окрашена в желтый цвет. Этот цвет ей придает оксид азота (IV), который образуется вследствие частичного разложения азотной кислоты. Плотность HNO3 равна 1,52 г/см3, температура кипения 86 °С, а при температуре -41,6 °С она затвердевает в виде прозрачной кристаллической массы. Азотная кислота очень гигроскопична. Она растворяется в воде в любых соотношениях и в водном растворе является сильным электролитом. В лаборатории обычно используется концентрированная 65%-ная азотная кислота плотностью 1,4 г/см3. В отличие от 100%-ной кислоты она не «дымит» на воздухе и способна сохраняться довольно долго.
Химические свойства. Разбавленная азотная кислота проявляет свойства, общие для всех кислот. Она изменяет окраску индикаторов, реагирует с основными оксидами и основаниями, как и другие кислоты. Задание. Со свойствами кислот как электролитов вы уже хорошо знакомы. Напишите уравнения соответствующих реакций для разбавленной азотной кислоты. 1. Азотная кислота — сильный электролит. В водном растворе она диссоциирует (в 1М растворе примерно на 82 %):
Реакции с индикаторами, основными оксидами и основаниями обусловлены свойствами азотной кислоты как электролита, а именно ее ионом Н+. Важнейшей из них является реакция нейтрализации: HNO3 + КОН = KNO3 + Н2O
Азотная кислота проявляет и специфические свойства. Она — сильный окислитель, что обусловлено прежде всего наличием атома азота в степени окисления +5. 2. Термическое разложение азотной кислоты. Азотная кислота — очень непрочное соединение. При комнатной температуре она разлагается на оксид азота (IV), воду и кислород: 4HNO3 = 2Н2O + 4NO2 + O2↑ Поэтому азотную кислоту следует хранить в темных бутылях в прохладном темном месте. При работе с азотной кислотой, особенно концентрированной, надо строго соблюдать правила техники безопасности. Они приведены на с. 91. Прочитайте их вновь.
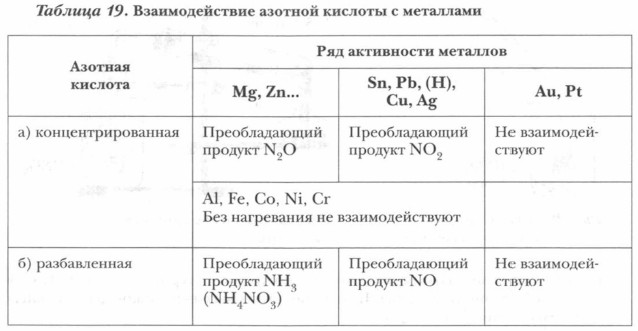
3. Взаимодействие с металлами является наиболее специфичным проявлением окислительных свойств азотной кислоты. Она реагирует не только с активными металлами, стоящими в ряду активности левее водорода, но и с малоактивными, стоящими справа от водорода, причем это относится как к концентрированной, так и к разбавленной азотной кислоте (сравните с серной кислотой). В ходе этой реакции водород кислоты не замещается атомами металла, а образуются газообразные соединения азота.
1. Возьмем две пробирки и в одну из них опустим кусочек цинка, в другую — меди. В каждую пробирку нальем раствор азотной кислоты (1:5). Немного подогреем пробирки. В обоих случаях наблюдаем реакцию. В пробирке с медью наблюдается выделение бесцветного газа NO, который окисляется в бурый NO2. Поднесем к пробирке с цинком зажженную лучинку — характерного хлопка водорода не слышится. Следовательно, водород не выделяется.
2. Возьмем пробирку с медью, добавим немного концентрированной азотной кислоты и слегка подогреем. Начинает активно выделяться бурый газ NO2: Сu + 4HNO3(конц) = Cu(NO3)2 + 2NO2t + 2Н2O (Уравнения не нужно запоминать. Необходимо пока лишь понять сущность процесса.) На основе проделанных опытов можно сделать следующие выводы. 1. Раствор азотной кислоты реагирует не только с металлами, стоящими в электрохимическом ряду активности металлов до водорода, но и с металлами, стоящими после водорода (сравните с растворами соляной и серной кислот). 2. В реакции с разбавленной азотной кислотой окислителем металлов является не ион водорода Н+ (как в случае с растворами соляной и серной кислот), а ион 3. Концентрированная азотная кислота также реагирует с металлами, стоящими в ряду активности правее водорода. Окислителем металлов в данном случае являются молекулы HNO3 за счет предельно окисленного атома азота (сравните с концентрированной серной кислотой). 4. В окислительно-восстановительных реакциях с металлами азотная кислота выступает как сильный окислитель за счет атомов N+5. Поэтому продуктами реакции являются различные соединения азота с более низкой степенью окисления азота, чем N+5. Азотная кислота не реагирует с золотом и платиной. Однако смесь концентрированной азотной и концентрированной соляной кислот в соотношении 1:3, называемая «царской водкой», действует на эти металлы, растворяя их. Это свойство данной смеси хорошо было известно алхимикам. Для более конкретного определения продукта реакции каждого из металлов с HNO3 следует обратиться к таблице 19. Взаимодействие металлов с HNO3 — сложный процесс, включающий не только окислительно-восстановительную реакцию, но и реакцию солеобразования. Поэтому для составления уравнений реакций HNO3 с металлами и правильной расстановки в них коэффициентов целесообразно обратиться к алгоритму и к схеме электронного баланса (см. ниже).
Концентрированной азотной кислотой легко окисляются многие неметаллы, сложные органические вещества. 4. Окисление неметаллов (S, Р, С и др.) азотной кислотой. Сера, например, окисляется азотной кислотой до серной кислоты при кипячении, уголь — до углекислого газа, фосфор — до ортофосфорной кислоты.
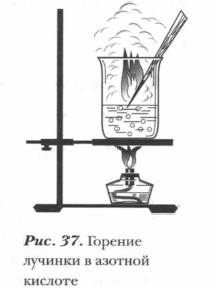
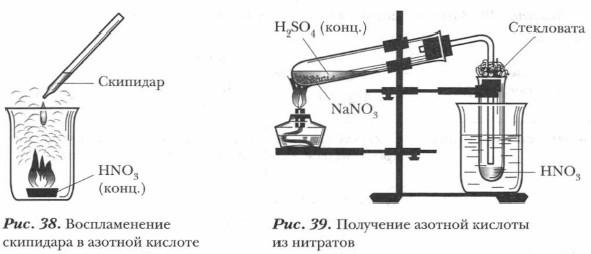
5. Окисление азотной кислотой органических веществ. Азотная кислота, особенно концентрированная, окисляет органические вещества. Если погрузить в концентрированную нагретую азотную кислоту тлеющую лучинку, она ярко вспыхивает (наличие свободного кислорода) (см. рис. 37). Скипидар, по каплям добавляемый в концентрированную азотную кислоту при обычных условиях, воспламеняется (рис. 38). Животные и растительные ткани быстро разрушаются при действии на них азотной кислоты. Даже небольшое количество разбавленной азотной кислоты оставляет на коже желтые пятна (вследствие взаимодействия с белками). При попадании на кожу концентрированной кислоты образуются болезненные язвы. Вдыхание паров вызывает ожог дыхательных путей и отравление (см. с. 122). При попадании азотной кислоты на кожу следует быстро смыть ее большим количеством воды, нейтрализовать слабым раствором питьевой соды, которую затем надо смыть водой.
Получение азотной кислоты. В лаборатории азотную кислоту получают взаимодействием калийной или натриевой селитры с концентрированной серной кислотой при нагревании (рис. 39):
В промышленности азотную кислоту получают каталитическим окислением аммиака, синтезированного из азотоводородной смеси, получаемой комбинированной конверсией (превращением) природного газа, на одной из стадий которой используется воздух, а следовательно, в конечном счете из воздуха. Перевозят концентрированную азотную кислоту в алюминиевых цистернах.
|
|
|



 Охарактеризуйте азотную кислоту как электролит. Напишите уравнения реакций азотной кислоты, доказывающие ее принадлежность к классу кислот.
Охарактеризуйте азотную кислоту как электролит. Напишите уравнения реакций азотной кислоты, доказывающие ее принадлежность к классу кислот.
 Это объясняется тем, что у атома азота имеется три неспаренных р-электрона на внешнем слое, за счет которых он может образовать с атомами кислорода три общие электронные пары. Но есть еще одна связь, образованная по донорно-акцепторному механизму благодаря неподеленной электронной паре азота. Поэтому число ковалентных связей равно четырем. Следовательно, валентность азота в кислоте также равна четырем.
Это объясняется тем, что у атома азота имеется три неспаренных р-электрона на внешнем слое, за счет которых он может образовать с атомами кислорода три общие электронные пары. Но есть еще одна связь, образованная по донорно-акцепторному механизму благодаря неподеленной электронной паре азота. Поэтому число ковалентных связей равно четырем. Следовательно, валентность азота в кислоте также равна четырем.
 Демонстрационный опыт. Разложение азотной кислоты. (Проводится под тягой!) Нагреем небольшое количество концентрированной азотной кислоты в химическом стакане и внесем в него тлеющую лучинку. Лучинка ярко вспыхивает, что доказывает наличие кислорода, выделяющегося при разложении кислоты (см. рис. 37).
Демонстрационный опыт. Разложение азотной кислоты. (Проводится под тягой!) Нагреем небольшое количество концентрированной азотной кислоты в химическом стакане и внесем в него тлеющую лучинку. Лучинка ярко вспыхивает, что доказывает наличие кислорода, выделяющегося при разложении кислоты (см. рис. 37).
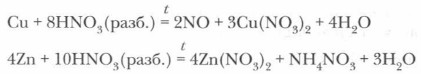
 , окислительные свойства которого сильнее, чем у катиона Н+.
, окислительные свойства которого сильнее, чем у катиона Н+.