|
|
|
|
|
Глава 6. Подгруппа углерода Угольная кислота и ее соли4. При нагревании многие карбонаты разлагаются с выделением углекислого газа:
а гидрокарбонаты переходят в карбонаты:
5. Карбонаты подвергаются гидролизу:
Присутствие в растворе ионов ОН- объясняет щелочную реакцию раствора. Задание. Проделайте лабораторные опыты, подтверждающие химические свойства солей угольной кислоты.
В пробирку с 2-3 мл свежеприготовленного раствора известковой воды пропустите углекислый газ. Что наблюдаете? Продолжайте пропускать углекислый газ через раствор. Как изменилась прозрачность раствора? Прокипятите полученный раствор. Объясните происходящие изменения.
В одну пробирку налейте 2-3 мл раствора карбоната натрия, в другую — столько же раствора карбоната калия, а в третью положите кусочек мела. Во все пробирки налейте 1-2 мл разбавленной соляной кислоты. Какие изменения вы наблюдаете? Сделайте вывод, как распознать соли угольной кислоты. Наибольшее практическое значение имеют следующие соли угольной кислоты. Карбонат натрия Na2CO3; техническое название — сода, углекислая сода, кальцинированная (безводная) сода. Кристаллическая сода — это кристаллогидрат Na2CO3 • 7Н2O; Na2CO3 • 10Н2О; Na2CO3 • Н2O. Сода используется в производстве стекла, мыла, бумаги; в быту — как моющее средство. Гидрокарбонат натрия NaHCO3; техническое название — питьевая сода, двууглекислая сода. Это белый порошок, использующийся для производства искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и в хлебопечении, в быту, в медицине. Карбонат калия К2СO3; техническое название — поташ. Это белый порошок. Он содержится в золе растений, используется в виде минерального удобрения, а также применяется в производстве жидкого мыла, тугоплавкого стекла. Карбонат кальция СаСО3; встречается в природе в виде известняка, мрамора, мела. Он используется в строительном деле. Основные понятия Угольная кислота • Карбонаты • Гидрокарбонаты • Качественная реакция на карбонат-ион Вопросы и задания
|
|
|




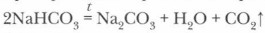
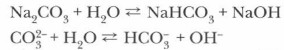
 Опыт 1. Взаимопревращение карбонатов и гидрокарбонатов.
Опыт 1. Взаимопревращение карбонатов и гидрокарбонатов.
 1. Осуществите следующие превращения, используя разные способы:
1. Осуществите следующие превращения, используя разные способы:
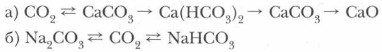
 2. Почему при пропускании углекислого газа через воду, подкрашенную лакмусом, ее окраска становится красной, а при кипячении полученного раствора — фиолетовой? Напишите уравнения соответствующих реакций.
2. Почему при пропускании углекислого газа через воду, подкрашенную лакмусом, ее окраска становится красной, а при кипячении полученного раствора — фиолетовой? Напишите уравнения соответствующих реакций.