|
|
|
|
|
Глава 8. Общие свойства металлов Химические свойства металловПри написании сложных уравнений окислительно-восстановительных реакций металлов используйте метод электронного баланса, основанный на законе сохранения зарядов реагентов и электронов в этих реакциях (см. учебник химии для 8 класса, § 60).
В этом процессе одна молекула HNO3 расходуется на окислительно-восстановительный процесс, а три — на образование соли. Закономерности окислительно-восстановительных реакцийОкислительно-восстановительные реакции металлов также подчинены этим общим закономерностям. 1. Единство и неразрывность процессов окисления и восстановления металла и его иона в окислительно-восстановительных реакциях. 2. Сохранение числа электронов в реакционной системе. На этом основано составление уравнений реакций методом электронного баланса. 3. Окислительно-восстановительная реакция протекает в сторону образования слабых окислителей из более сильных (эта закономерность изучена нами на примере взаимодействия азотной кислоты разной концентрации с медью). 4. При наличии в системе двух или более окислителей и восстановителей реагируют более сильные (например, в растворе азотной кислоты имеются два вида окислителей — ионы гидроксония и нитрат-ионы. Последние более сильные, поэтому преимущественно продуктами ее восстановления будут соединения азота). Обобщая все химические реакции металлов, сущность их можно свести к краткой и общей схеме:
Основные понятия Металлы-восстановители • Закономерности окислительно-восстановительных реакций металлов Вопросы и задания
|
|
|



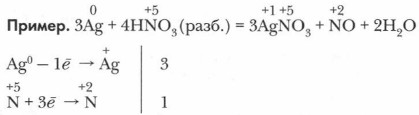
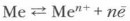
 1. Назовите основные характеристики элементов-металлов.
1. Назовите основные характеристики элементов-металлов.
 2. С какими из веществ, формулы которых даны ниже, будут реагировать калий (а), медь (б): НСl, O2, NaOH, ZnCl2, Cl2, Н2O, HNO3 (конц.)? Напишите уравнения возможных реакций.
2. С какими из веществ, формулы которых даны ниже, будут реагировать калий (а), медь (б): НСl, O2, NaOH, ZnCl2, Cl2, Н2O, HNO3 (конц.)? Напишите уравнения возможных реакций.
 5. Приведите примеры использования реакций металлов. Раскройте их суть.
5. Приведите примеры использования реакций металлов. Раскройте их суть.
 6. К какому типу элементов по электронной структуре и характеру относится элемент с порядковым номером 30? Докажите это.
6. К какому типу элементов по электронной структуре и характеру относится элемент с порядковым номером 30? Докажите это.