|
|
|
|
|
Глава 9. Металлы главных и побочных подгрупп Характеристика s-элементов IA-группы периодической системы и образуемых ими простых веществХимические свойства щелочных металлов.Систематизируем сведения о химических реакциях, характерных для щелочных металлов. 1. В случае взаимодействия щелочных металлов с кислородом различны не только условия и признаки протекания реакций, но и характер образующихся продуктов. Литий, натрий и калий интенсивно окисляются на воздухе и в кислороде (без возгорания), рубидий и цезий на воздухе самовозгораются (поэтому их хранят в вакууме в запаянных ампулах). При окислении лития образуется оксид:
При взаимодействии натрия с кислородом образуется пероксид:
Пероксиды щелочных металлов — очень сильные окислители. Они бурно реагируют с водой, причем реакция сопровождается выделением кислорода. 2. Все щелочные металлы активно взаимодействуют с водой:
3. Так же легко щелочные металлы вступают в реакции с галогенами: в атмосфере фтора и хлора калий, рубидий и цезий воспламеняются, с бромом реагируют с сильным взрывом. 4. При нагревании щелочные металлы взаимодействуют с серой, водородом, с другими металлами часто образуют интерметаллические соединения. 8Na + 5H2SO4(конц.) = 4Na2SO4 + H2S↑ + 4H2O
Области применения щелочных металлов обусловлены их физико-химическими свойствами и весьма разнообразны. Например, литий и натрий легко взаимодействуют с кислородом воздуха и другими газообразными веществами. Поэтому их используют для удаления пузырьков газа из сплавов металлов.
Многие сплавы щелочных металлов обладают уникальными свойствами. Например, сплав свинца, натрия, лития и кальция способен сжиматься на 28%, сохраняя при этом твердость и не растрескиваясь. Его применяют для изготовления осевых подшипников для железнодорожного транспорта, поскольку они работают в условиях постоянных и резко сменяющихся нагрузок.
Большая химическая активность цезия по отношению к веществам, образующим воздух, используется для изготовления радиоламп. Для создания вакуума в колбу лампы вносят мельчайший кусочек цезия, который мгновенно поглощает те остатки воздуха, которые нельзя откачать насосом.
Одним из наиболее замечательных свойств рубидия и цезия является чувствительность к свету. При освещении поверхности металла он становится источником электрического тока (возникает поток электронов), при прекращении освещения ток прекращается. Приборы, в которых световая энергия превращается в электрическую, называются фотоэлементами. Они широко используются в звуковом кино, телевидении. Лучшие фотоэлементы делают из сплава сурьмы и цезия.
Одно из основных применений калия — использование его супероксида для регенерации кислорода в подводных лодках:
Na2O2 + К2O4 + 2СO2 = Na2CO2 + К2СО2 + 2O2↑
Едкие щелочи применяются для изготовления мыла, бумаги, электролитов для аккумуляторов, в очистке нефтепродуктов, в производстве искусственных волокон, в синтезе многочисленных органических и неорганических веществ.
Соединения всех щелочных металлов применяются в медицине. Например, соли лития способны растворять отложения мочевой кислоты, поэтому их применяют для лечения подагры. На основе бромидов и иодидов рубидия созданы болеутоляющие и успокаивающие средства. Примечательно, что существуют проекты относительно использования в медицине даже франция! Установлено, что он избирательно накапливается в раковых опухолях на ранних стадиях их развития. Это свойство могло бы послужить для ранней диагностики заболевания.
Создаются удивительные проекты новых областей применения и для вполне привычных веществ, например каменной соли (галита). Кристаллы каменной соли непроницаемы для жидких и газообразных веществ. Это служит основанием для предложения о создании в залежах галита огромных емкостей для хранения нефти и газа.
Основные понятия s-Элементы • Щелочные металлы: структура атомов, вид кристаллической решетки • Оксид • Пероксид • Супероксид Вопросы и задания
|
|
|



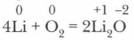

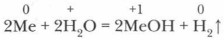
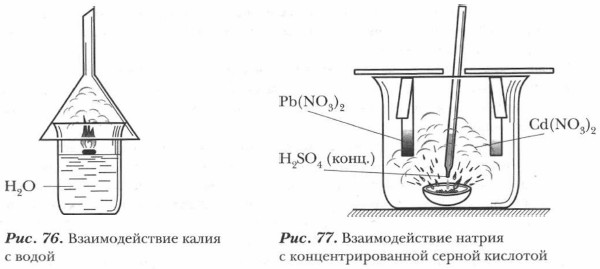
 Но и в этом случае они ведут себя по-разному: литий и натрий реагируют с водой интенсивно, но не воспламеняются в процессе реакции. Калий загорается при взаимодействии с водой (рис. 76). Возгорание калия происходит через несколько секунд после начала реакции: образующийся водород, окрашенный парами калия, сгорает красивым фиолетовым пламенем. Взаимодействие с водой рубидия и цезия сопровождается взрывом. Эти металлы способны вступать в реакцию с водой даже при низких температурах! (Цезий реагирует со льдом при температуре -116 °С.)
Но и в этом случае они ведут себя по-разному: литий и натрий реагируют с водой интенсивно, но не воспламеняются в процессе реакции. Калий загорается при взаимодействии с водой (рис. 76). Возгорание калия происходит через несколько секунд после начала реакции: образующийся водород, окрашенный парами калия, сгорает красивым фиолетовым пламенем. Взаимодействие с водой рубидия и цезия сопровождается взрывом. Эти металлы способны вступать в реакцию с водой даже при низких температурах! (Цезий реагирует со льдом при температуре -116 °С.)
 С какой целью к стенке стакана (рис. 77) прикреплены полоски бумаги, смоченные растворами Pb(NO3)2 и Cd(NO3)2?
С какой целью к стенке стакана (рис. 77) прикреплены полоски бумаги, смоченные растворами Pb(NO3)2 и Cd(NO3)2?
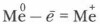
 1. Охарактеризуйте физические свойства лития.
1. Охарактеризуйте физические свойства лития.
 2. На конкретных примерах раскройте взаимосвязь между строением и свойствами щелочных металлов.
2. На конкретных примерах раскройте взаимосвязь между строением и свойствами щелочных металлов.
 3. Франций не был получен в количествах, достаточных для его подробного изучения. Однако опытным путем подтверждены некоторые предсказания относительно его свойств. На основании чего были сделаны предсказания?
3. Франций не был получен в количествах, достаточных для его подробного изучения. Однако опытным путем подтверждены некоторые предсказания относительно его свойств. На основании чего были сделаны предсказания?
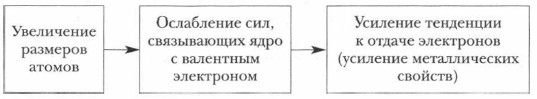
 6. Учитывая закономерное изменение радиусов ионов щелочных металлов, попытайтесь схематически представить, сколько ион-атомов каждого металла поместится в произвольно выбранной вами единице объема. Как изменения физических свойств щелочных металлов объяснить особенностями их строения? Полученные выводы оформите в виде схемы (схема 6).
6. Учитывая закономерное изменение радиусов ионов щелочных металлов, попытайтесь схематически представить, сколько ион-атомов каждого металла поместится в произвольно выбранной вами единице объема. Как изменения физических свойств щелочных металлов объяснить особенностями их строения? Полученные выводы оформите в виде схемы (схема 6).