|
|
|
|
|
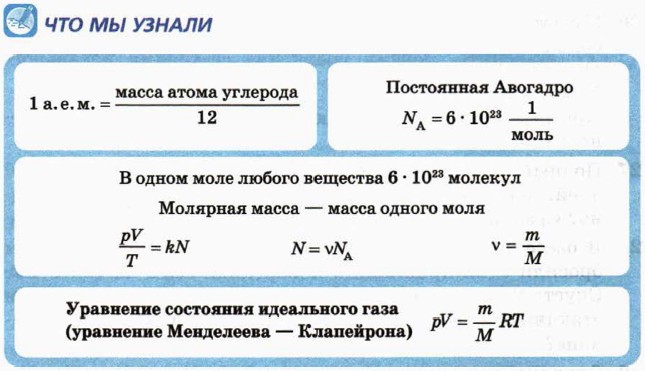
§ 40. Уравнение состояния идеального газа Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона) (окончание)
р = nkT.
а) Чему равна при этом концентрация молекул? б) Различаются ли концентрации молекул различных газов при нормальных условиях? Обоснуйте свой ответ. в) Сколько молекул воздуха вы вдыхаете при глубоком вдохе при 0 °С, если объём лёгких увеличивается при этом на 2 л? Давление в лёгких считайте равным атмосферному. Изменение массы газаИз уравнения состояния идеального газа следует, что для одного и того же газа значение выражения
а) Во сколько раз увеличилась абсолютная температура газа? б) Во сколько раз увеличилось давление газа? в) Осталось ли неизменным значение выражения г) На сколько уменьшилось число молей газа? д) Насколько уменьшилась масса газа? Изменение числа молекул вследствие изменения состава молекулыЗначение выражения
а) Во сколько раз увеличилась абсолютная температура газа? б) Во сколько раз увеличилось число молекул газа? в) Каким стало давление газа?
|
|
|



 17. Объясните, почему уравнение состояния идеального газа можно записать в виде
17. Объясните, почему уравнение состояния идеального газа можно записать в виде
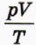 пропорционально массе газа.
пропорционально массе газа.