|
|
|
|
|
§ 41. Абсолютная температура и средняя кинетическая энергия молекул Основное уравнение молекулярно-кинетической теорииИдеальный газЕсли потенциальной энергией взаимодействия молекул в газе можно пренебречь по сравнению с кинетической энергией их хаотического движения, то можно считать, что вся внутренняя энергия газа — это сумма кинетических энергий его молекул. Такую упрощённую модель реального газа называют идеальным газом. Молекулярно-кинетическая теория идеального газа объясняет свойства газов, рассмотренные в предыдущем параграфе. Согласно этой теории давление газа обусловлено частыми ударами молекул.
Исходя из того, что давление газа создаётся ударами молекул, немецкий физик Рудольф Клаузиус вывел соотношение
где р — давление газа, n — концентрация его молекул, m0 — масса молекулы,
Здесь N — число молекул в газе. Уравнение (1) называют основным уравнением молекулярно-кинетической теории идеального газа. Запишем это уравнение с учётом того, что средняя кинетическая энергия
1 Если молекула состоит более чем из одного атома, у неё есть также кинетическая энергия вращательного движения. Расчёт, выходящий за рамки нашего курса, показывает, что при нахождении давления газа её учитывать не нужно.
|
|
|





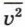 — среднее значение квадрата скорости молекул, которое определяется формулой
— среднее значение квадрата скорости молекул, которое определяется формулой

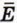 поступательного1 движения молекулы связана со средним квадратом её скорости
поступательного1 движения молекулы связана со средним квадратом её скорости 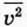 соотношением
соотношением
