|
|
|
|
|
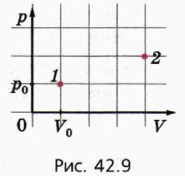
§ 42. Первый закон термодинамики Первый закон термодинамики (окончание)Обусловлено это тем, что каждому состоянию данной массы газа (с определёнными значениями р, V и Т) соответствует одно определённое значение внутренней энергии, которое можно найти либо по формуле (1), либо по формуле (2). А вот работа, совершённая газом при переходе из начального состояния в конечное, зависит от характера процесса, которым газ был переведён из начального состояния в конечное. Действительно, работа газа численно равна площади под графиком зависимости p(V). А эта площадь зависит от того, какой вид имела функция p(V). Если газ не расширяется, а сжимается (рис. 42.8), то внешние силы производят работу над газом. В таком случае говорят также, что газ производит отрицательную работу. Она численно равна взятой со знаком минус площади S под графиком зависимости p(V).
На том, что работа газа зависит от вида зависимости р(V), а не только от начального и конечного состояния, основан принцип действия тепловых двигателей (в следующем параграфе мы рассмотрим их подробнее). В тепловых двигателях газ расширяется при высокой температуре. При этом давление газа велико, поэтому он совершает большую работу. А сжимают газ при более низкой температуре, когда давление газа меньше. Поэтому для того, чтобы вернуть газ в начальное состояние, внешние силы должны совершить меньшую работу. Рассмотрим пример.
а) Какую максимально возможную работу может совершить газ при переходе 1—2, если давление газа не должно превышать 3р0? б) Какую минимально возможную работу должны совершить внешние силы при переходе 2—1, если давление газа не должно быть меньше р0? в) Насколько в этом случае работа газа при циклическом процессе больше работы внешних сил? Применение первого закона термодинамики к изопроцессам и адиабатному процессу
а) при изохорном процессе Аr = О, Q = ΔU, то есть сообщённое газу количество теплоты (напомним, что оно может быть как положительным, так и отрицательным) равно изменению внутренней энергии газа; б) при изотермическом процессе ΔU = О, Q = Аr, то есть сообщённое газу количество теплоты равно работе газа; в) при изобарном процессе Аr ≠ 0, ΔU ≠ 0; г) при адиабатном процессе Q = 0, Аr = -ΔU, то есть при расширении газ совершает работу за счёт уменьшения внутренней энергии, а при сжатии газа его внутренняя энергия увеличивается за счёт работы внешних сил. Подсказка. Если давление не изменяется, то Δ(pV) = pΔV.
|
|
|



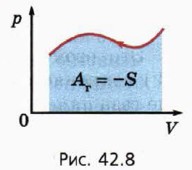
 12. Газ совершает циклический процесс: переходит из состояния 1 в состояние 2 (рис. 42.9), а потом возвращается в состояние 1. При этом объём газа не должен быть меньше начального и больше конечного.
12. Газ совершает циклический процесс: переходит из состояния 1 в состояние 2 (рис. 42.9), а потом возвращается в состояние 1. При этом объём газа не должен быть меньше начального и больше конечного.