|
|
|
|
|
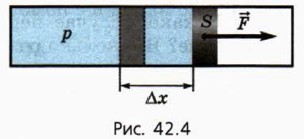
§ 42. Первый закон термодинамики Первый закон термодинамикиИтак, внутренняя энергия газа U может изменяться как вследствие того, что ему сообщают количество теплоты Q, так и потому, что внешние силы совершают работу А над газом. Согласно закону сохранения энергии изменение внутренней энергии газа ΔU равно сумме количества теплоты Q, переданного газу, и работы А, совершённой над газом: ΔU = Q + А. (3) Закон сохранения энергии применительно к тепловым явлениям называют первым законом термодинамики1. 1 Термодинамикой называют раздел физики, изучающий общие законы тепловых явлений. Как Q, так и А могут быть положительными, отрицательными или равными нулю. Если газ сжимают, то А > 0, а если он расширяется, то А < 0. Если объём газа не изменяется, то А = 0. Если газу передают некоторое количество теплоты, то Q > 0, а если газ отдаёт некоторое количество теплоты, то Q < 0. В практических расчётах и при решении многих задач часто используют другую формулировку первого закона термодинамики. Дело в том, что при рассмотрении тепловых двигателей главный интерес представляет работа, совершённая самим газом (то есть силой давления, действующей со стороны газа на поршень; при расширении газа работа газа положительна). Обозначим работу газа Аr. Она связана с работой А, совершённой внешними силами над газом, соотношением Аr = -А. При сжатии газа А > 0, Аr < 0; а при расширении газа А < 0, Аr > 0. Используя понятие работы газа, первый закон термодинамики формулируют так: количество теплоты, переданное газу, равно сумме изменения внутренней энергии газа и работы, совершённой газом: Q = ΔU + Ar. (4) Чтобы использовать соотношения (3) и (4) на практике, надо уметь находить выражения для изменения внутренней энергии газа и работы газа (или работы внешних сил). Как найти изменение внутренней энергии газа?Для одноатомного идеального газа внутренняя энергия выражается формулой (1), поэтому для изменения ΔU внутренней энергии получаем:
Здесь ΔТ = Т2 - T1, ΔU = U2 - U1, а индексами 1 и 2 обозначены соответственно начальное и конечное состояния газа.
а) Насколько увеличилась внутренняя энергия газа? б) Есть ли в условии лишние данные? Изменение внутренней энергии одноатомного идеального газа можно найти и с помощью формулы (2):
Здесь Δ(pV) — изменение произведения давления на объём. Например, при переходе газа из состояния 1 в состояние 2 Δ(pV)=p2V2 - p1V1. (7) 8
а) при изобарном расширении, если давление газа равно р0, а объём газа увеличился от V0 до 3V0? б) при изохорном охлаждении, если объём газа равен V0, а давление газа уменьшилось от р0 до 0,5р0? в) в процессе, в котором начальные давление и объём газа равны р0 и V0, а. конечные равны 2р0 и 3F0? Есть ли в условии лишние данные?
|
|
|




 7. Начальная температура пяти молей гелия 100 °С. Газ нагрели на 50 °С.
7. Начальная температура пяти молей гелия 100 °С. Газ нагрели на 50 °С.