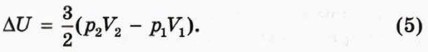|
|
|
|
|
§ 47. Применение первого закона термодинамики к газовым процессам Изопроцессы и адиабатный процессНапомним, что согласно первому закону термодинамики количество теплоты Q, переданное газу, связано с изменением внутренней энергии газа ΔU и работой газа Аг соотношением Q = ΔU + Аг. (1) Часто требуется применять первый закон термодинамики к газовым процессам, представляющим собой последовательность изопроцессов (иногда добавляется ещё адиабатный процесс). Рассмотрим, как находить величины, фигурирующие в формуле (1), в этих процессах. Напомним, что каждая из этих величин может быть положительной, отрицательной или равной нулю. Если график газового процесса задан не в координатах (р, V), то желательно начертить график этого же процесса в координатах (р, V), потому что с помощью этого графика легко найти работу газа. Напомним, что работа газа при расширении численно равна площади под графиком зависимости p(V), а при сжатии газа — площади под тем же графиком, но взятой со знаком минус. В большинстве задач на эту тему рассматривается одноатомный идеальный газ. Напомним, что его внутренняя энергия выражается формулой
где ν — количество вещества (число молей), R — универсальная газовая постоянная, Т — абсолютная температура.
Из формулы (2) и уравнения состояния идеального газа pV = νRT (3) следует, что внутреннюю энергию одноатомного идеального газа можно выразить также формулой
С помощью этой формулы можно находить изменение внутренней энергии одноатомного идеального газа, если известны начальные и конечные значения давления и объёма газа. Например, если начальные значения давления и объёма обозначить р1 и V1 а конечные — р2 и V2, то
|
|
|




 1. Чему равно изменение внутренней энергии газа в изотермическом процессе?
1. Чему равно изменение внутренней энергии газа в изотермическом процессе?